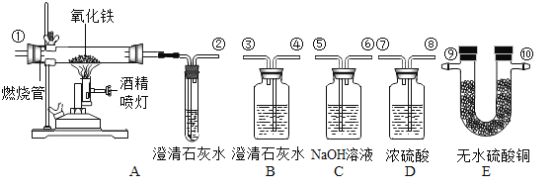
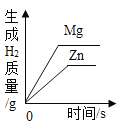
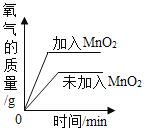
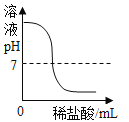
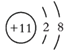题目内容
【题目】生活中处处有化学。
(1)市场上销售的食盐种类有加钙盐、加锌盐、加碘盐等。所谓“加碘盐”是指在一定量的食盐中加入一定量的碘酸钾(化学式为KIO3),请写出碘酸钾中碘元素的化合价______。
(2)煤、石油和_________常被称为化石燃料,大量燃煤(含杂质硫、氮等)造成的主要环境问题有_______(答出一点即可)。
(3)在含有硫酸镁、硫酸铜的工业废水中加入过量的锌粉,充分反应后过滤,所得滤渣是(填写化学式)____________。
(4)氢化钙(CaH2)固体可用于登山队员的能源提供剂,它和水反应生成氢氧化钙和氢气。请写出每千克该物质的能够制取的氢气质量为____________g(保留到0.1g)。
【答案】+5 天然气 酸雨 Zn、Cu 95.2
【解析】
(1)钾元素通常为+1价,氧元素通常为-2价,设碘酸钾中碘元素的化合价为x,根据化合物中,正、负化合价的代数和为零,可得:(+1)+x+(-2)×3=0,x=+5;
(2)煤、石油和天然气常被称为化石燃料;
大量燃煤(含杂质硫、氮等)造成的主要环境问题有:酸雨、温室效应等;
(3)在含有硫酸镁、硫酸铜的工业废水中加入过量的锌粉,在金属活动性顺序里,镁位于锌之前,锌不与硫酸镁反应,铜位于锌之后,锌能与硫酸铜反应生成硫酸锌和铜,故滤渣是:Zn、Cu;
(4)氢化钙(CaH2)固体能和水反应生成氢氧化钙和氢气,该反应的化学方程式为:![]()
设制取氢气的质量为x
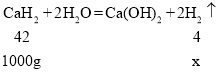
![]()
x≈95.2g,每千克该物质的能够制取的氢气质量为95.2g。

 口算能手系列答案
口算能手系列答案【题目】铝作为金属材料在近200多年的历史中被广泛应用。根据下列资料回答:
物质的相关信息 | 铜 | 铝 |
密度(g/cm3) | 8.92 | 2.70 |
地壳中含量(质量分数/%) | 0.007 | 7.73 |
导电性(以银的导电性为100作标准) | 99 | 61 |
(1)铝的导电性比铜小,为什么高压电线常用铝制_____?
(2)用铝制高压电线时外面不需要包绝缘体,用化学方程式表示原因_____。
(3)飞机外壳用硬铝制而不用铝制的原因_____。