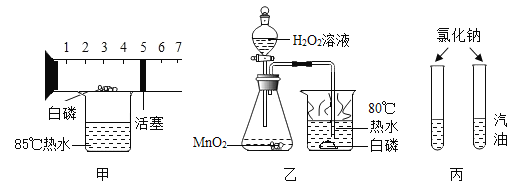
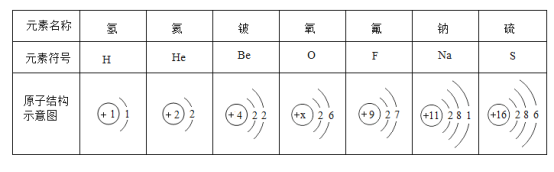
题目内容
【题目】实验室有一瓶碳酸钙和氯化钙粉末组成的均匀混合物,小科用相同溶质质量分数的稀盐酸和该混合物反应(所得溶液均为不饱和溶液),四组实验数据记录如下表,请分析计算:)
实验组别 | 一 | 二 | 三 | 四 |
稀盐酸质量/g | 100.0 | 100.0 | 100.0 | 100.0 |
混合物质量/g | 3.0 | 6.0 | 9.0 | 12.0 |
所得溶液质量/g | 101.9 | 103.8 | 105.0 | a |
剩余固体质量/g | 0 | 0 | m | n |
(1)原混合物中碳酸钙与氯化钙的质量比为_____________;
(2)求表中m的值____________ (要求写出完整的过程)。
【答案】5:1 1.25
【解析】
根据图表中数据分析,每消耗3.0g混合物,溶液增加1.9g,第三次加入混合物9.0g,溶液增加质量为5.0g,小于1.9g×3,说明混合物剩余,稀盐酸完全反应,第一、二组稀盐酸还有剩余。由于第三组混合物剩余,稀盐酸完全反应。
(1)由第一组数据可知,生成二氧化碳的质量为100.0+3.0g-101.9g=1.1g.
设3.0g混合物中碳酸钙的质量为x 。
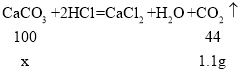
![]()
x=2.5g
混合物中碳酸钙和氯化钙质量之比为2.5g:(3.0g-2.5g)=5:1。
(2)第三组中产生二氧化碳的质量为100.0g+9.0g-105.0g-m=4.0g-m。
设反应的碳酸钙的质量为y
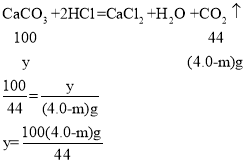
9.0g混合物中的碳酸钙质量=![]() ,m=1.25。
,m=1.25。
答:(1)混合物中碳酸钙和氯化钙质量之比为5:1。
(2)表中m的值为1.25。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
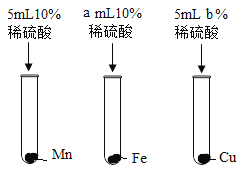
小学生10分钟应用题系列答案【题目】金属材料在生产生活中应用广泛。化学实验小组的同学为了解Mn、Fe、Cu三种金属的活动性顺序,进行了如下探究活动。
[作出猜想]对Mn的活动性提出了三种猜想:
猜想一、_____;猜想二、Fe>Mn>Cu;猜想三、Fe>Cu>Mn。
[实验验证]
实验步骤 | 实验方案 | 实验现象 | 实验结论 |
① |
| _____ | 猜想三错误 |
② | 将锰加入硫酸亚铁溶液中 | 有黑色固体析出 | 猜想_____正确 |
(1)步骤①的实验方案中,a和b的数值应分别是_____。
(2)已知Mn在生成物中显+2价,则步骤②中反应的化学方程式为_____。
[拓展延伸]若将步骤①和②中反应后的混合物倒入同一烧杯中,搅拌、过滤,得到固体X和溶液Y ;再向溶液Y中加入铁粉,有气泡产生。则溶液Y中溶质的成分_____(填字母)。
A 一定有FeSO4
B 一定有MnSO4
C 可能有H2SO4
D 可能有CuSO4
[反思与应用]活动性越强的金属,越容易在空气中发生化学变化。铁生锈的条件是_____。