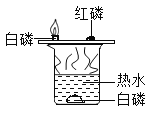
题目内容
【题目】某同学为探究纯金属及其合金性质,进行了如下实验。
0-1小时 | 1 小时-2小时 | 2小时-3小时 | |
5%的稀硫酸 | 无气泡产生 | ||
15%的稀硫酸 | 无气泡 | 少量小气泡,反应缓慢 | 少量小气泡增加不明显,缓慢 |
表:黄铜片与不同浓度的稀硫酸
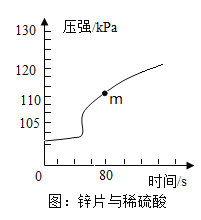
(1)取锌片于密闭容器中,加入足量5%的稀硫酸,反应时气体压强的变化曲线如图。开始时容器内气体压强几乎不变,共原因是_____________。 m点时,所得溶液中除水之外还含有的物质有______________。
(2)另取两片相同的黄铜(铜锌合金,含锌量与实验1相同),分别放入足量不同浓度的稀硫酸中,观察记录实验现象如表。分析可知,制成合金的一个目的是_____________。
(3)某工厂废液池中溶液的主要成分是硫酸锌、硫酸铜和硫酸,生产过程中还回收了一些锌粉。若只利用废液和锌粉制铜,请设计实验方案_____________。
【答案】锌片表面有一层氧化锌薄膜 硫酸锌、稀硫酸 提高耐腐蚀性 向废液中加入稍过量的锌粉,充分反应后过滤,向滤渣中加入废液至没有气泡产生,过滤、洗涤、干燥即得到铜
【解析】
(1)开始时容器内气体压强几乎不变,其原因是锌片表面有一层氧化锌薄膜,氧化锌先与稀硫酸反应生产硫酸锌和水,故压强几乎不变;
m点时,锌与稀硫酸发生了反应生成硫酸锌和氢气,m点时,所得溶液中除水之外还含有硫酸锌和硫酸;
(2)由表可知,硫酸浓度较低时,黄铜几乎不与硫酸反应,硫酸浓度提高,黄铜与硫酸反应也比较缓慢,故制成合金的一个目的是提高耐腐蚀性;
(3)废液中含硫酸锌、硫酸铜和硫酸,若只利用锌粉和废液制铜,可利用锌与硫酸铜反应生成硫酸锌和铜,故设计实验方案:向废液中加入稍过量的锌粉,充分反应后过滤,向滤渣中加入废液至没有气泡产生,过滤、洗涤、干燥即得到铜。

 计算高手系列答案
计算高手系列答案【题目】下列是分析已变质氢氧化钠溶液的相关实验,其中合理的是( )
选项 | 实验目的 | 实验过程 |
① | 证明变质 | 取少量溶液,滴加足量盐酸,将生成的气体通入澄清石灰水 |
② | 确定成分 | 取少量溶液,加入石灰水,过滤,向滤液中滴加酚酞溶液 |
③ | 测定纯度 | 取一定量溶液,加入盐酸,用氢氧化钠固体吸收生成的气体,称量 |
④ | 除去杂质 | 取溶液,滴加石灰水至恰好完全反应,过滤 |
A.②③B.①③C.②④D.①④
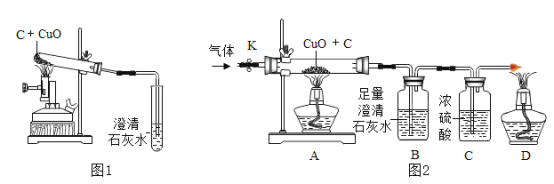
【题目】碳还原氧化铜的实验如图1所示。写出该反应的化学方程式:________。
[提出问题]碳燃烧时可能生成CO2也可能生成CO,那么碳与氧化铜反应生成的气体是否也有多种可能?
[作出猜想]猜想①:CO。猜想②:CO2。猜想③:________。
[设计方案]实验装置如图2(浓硫酸具有吸水作用)。打开K,缓缓通人干燥的氮气一段时间,关闭K,点燃酒精喷灯和酒精灯,充分反应后,熄灭酒精喷灯和酒精灯,打开K,再通一段时间氮气。
方案一:从定性观察角度判断
(1)实验时A处的现象是_______。
(2)若B中无明显实验现象,D处气体能被点燃,则猜想______(填序号)成立。
方案二:从定量计算角度判断
取一定量炭粉和4g氧化铜的混合物进行实验,并测定表格中的四个数据:
反应前的质量 | 反应后的质量 | |
A(玻璃管+固体) | m1 | m2 |
B +C(广口瓶+混合液) | m3 | m4 |
(3)若猜想②成立,则理论上(m4-m3)______(填“<”“=”或“>”)(m1-m2)。
(4)若猜想③成立且CuO全部转化成Cu,则参加反应的碳的质量m的取值范围是_____。
[交流反思]实验开始前缓缓通入氮气的目的是_______。