题目内容
【题目】实验室用下图所示装置制取氧气并完成相关实验(夹持仪器已略去),根据实验回答:
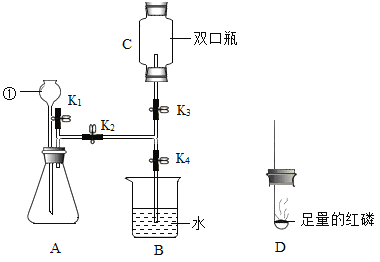
(1)仪器①的名称是___________。
(2)A装置中反应的化学方程式为___________
(3)用C装置收集气体的方法是______________(填选项字母)
A 排水法 b 向下排空法 c 向上排空法
(4) 检验C中收集满气体的方法是________
(5) C中收集满氧气后,打开弹簧夹K1、K4,关闭K2、K3,其中打开K1的目的是________点燃D中燃烧匙内的红磷后,立即伸入C装置中并把塞子塞紧,观察到红磷燃烧的现象是________。待红磷熄灭,C装置冷却后,打开K3观察到的现象是________
【答案】长颈漏斗 2H2O2![]() 2H2O + O2↑ c 将带火星的木条靠近C装置上端瓶口,木条复燃则满 排出A中继续产生的气体,防止瓶内压强过大 黄色火焰、放热、产生大量白烟 烧杯B中的水进入装置C
2H2O + O2↑ c 将带火星的木条靠近C装置上端瓶口,木条复燃则满 排出A中继续产生的气体,防止瓶内压强过大 黄色火焰、放热、产生大量白烟 烧杯B中的水进入装置C
【解析】
(1)由图可知,仪器①的名称是长颈漏斗,故填长颈漏斗。
(2)由图可知,A为固液常温发生装置,其中的反应是过氧化氢在二氧化锰作催化剂的条件下反应生成水和氧气,故反应的化学方程式写为:2H2O2![]() 2H2O + O2↑。
2H2O + O2↑。
(3)由图可知,生成的氧气从装置C中的双口瓶的下瓶口进入,原瓶中的空气从上瓶口排到空气中,该方法为向上排空气法,故填c。
(4)C装置收集气体的方法是向上排空气法,用向上排空气法收集氧气验满的方法是利用氧气的助燃性,将带火星的木条靠近C装置上端瓶口,木条复燃则满,故填将带火星的木条靠近C装置上端瓶口,木条复燃则满。
(5)关闭K2后,装置A中的反应继续发生,生成更多的氧气,装置内的压强越来越大,甚至会将双孔橡皮塞弹出,打开K1能排出A中继续产生的气体,防止瓶内压强过大,故填排出A中继续产生的气体,防止瓶内压强过大;
装置C中为氧气,红磷在氧气中燃烧的现象是发出黄色火焰、放热、产生大量白烟,故填黄色火焰、放热、产生大量白烟;
红磷在氧气中燃烧后生成五氧化二磷粉末,双口瓶中的压强减小,且远小于瓶外的大气压,打开K3后,大气压将烧杯中的水压入双口瓶中,观察到的现象是烧杯B中的水进入装置C,故填烧杯B中的水进入装置C。

 阅读快车系列答案
阅读快车系列答案【题目】如图的加热袋常用于野外加热食物。加热袋中的固体粉末含镁粉、铁粉和氯化钠,使用时向其中加入水袋中的水,即可产生大量热。实验小组针对放热过程中的反应原理展开探究。


【查阅资料】
常温下镁粉能与水发生置换反应,且放热。
【进行实验】
同学们用下图所示装置进行模拟实验:分别取不同成分的固体粉末放入甲中,通过分液漏斗向其中均加入8 mL水,读取甲中所得固液混合物的最高温度,实验记录如下表:
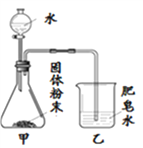
(实验时的室温为22.8℃)
实验序号 | A | B | C | D | E | F |
固体成分 | Mg | Fe | Mg+Fe | Mg+NaCl | Fe+NaCl | Mg+Fe+NaCl |
乙中现象 | 少量肥皂泡,难以点燃 | ______ | 少量肥皂泡,难以点燃 | 较多肥皂泡,点燃有爆鸣声 | 无肥皂泡 | 大量肥皂泡,点燃有爆鸣声 |
混合物温度 | 23.1℃ | 22.8℃ | 23.1℃ | 24.2℃ | 22.8℃ | 27.2℃ |
【解释与结论】
(1)实验B,乙中现象为_______________。
(2)实验A证明了镁粉与水能反应,完成该反应的化学方程式Mg+2H2O=____+H2 ![]() 。
。
(3)使镁粉与水迅速反应并放热的最佳方法是向镁粉中加入_____________。
【反思改进】
(4)同学们分析实验数据发现,升高的温度没有达到食品加热袋的效果,其可能的原因是___________。
(5)同学们根据实验结果进一步猜测,实验F中的反应结束后,甲中剩余固体混合物中仍然含有铁粉,检验其铁粉存在的的实验方案为:取少量固体混合物________。