题目内容
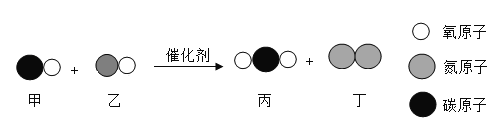
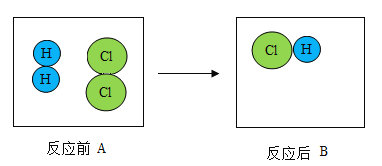
【题目】下图是氢气和氯气发生反应的微观模拟图,“![]() ”代表氢原子,“
”代表氢原子,“![]() ”代表氯原子,请回答下列问题:
”代表氯原子,请回答下列问题:
(1)在B图中将相关粒子图形补充完整_____。
(2)A中两种分子的相同点是_____。
(3)某元素的原子比一个B分子少两个质子,画出该原子的离子结构示意图_____。
【答案】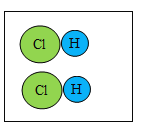 每种分子都由一种原于构成或分子均由同种原于构成或每个分子都由2个原子构成
每种分子都由一种原于构成或分子均由同种原于构成或每个分子都由2个原子构成 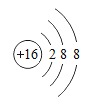
【解析】
(1)根据质量守恒反应前后原子的种类数目变可得反应后B为: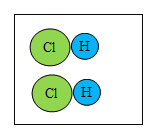 。
。
(2)由图可知A中两种分子的相同点是每种分子都由一种原于构成或分子均由同种原于构成或每个分子都由2个原子构成,故填:每种分子都由一种原于构成或分子均由同种原于构成或每个分子都由2个原子构成。
(3)由图可知B分子为氯化氢分子,该分子由18个质子,某元素的原子比一个B分子少两个质子,故为16个质子,为硫原子,该原子易得到两个电子,形成离子,结构示意图为: 。
。

 阅读快车系列答案
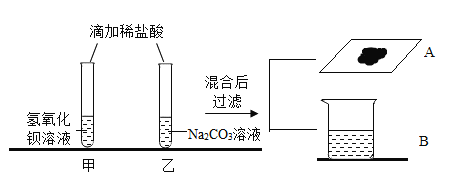
阅读快车系列答案【题目】某化学兴趣小组的同学,通过咨询老师准备用亚硫酸钠溶液与浓硫酸反应来制备一定量的SO2(Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H 2O),老师给他们提供了一瓶久置的亚硫酸钠溶液,兴趣小组的同学分成甲、乙两小组对该瓶亚硫酸钠溶液成分进行实验探究。
(查阅资料)
① Na2SO3不稳定,在空气中易被氧气氧化成Na2SO4;
②SO32-、SO42-均能与Ba2+反应产生白色沉淀;
③BaSO3 等亚硫酸盐能与稀盐酸反应,其反应原理与 BaCO3等碳酸盐与稀盐酸反应类似。
(1)(提出问题)①该瓶溶液中溶质的成分是什么?
②该瓶溶液中亚硫酸钠的质量分数是多少?
(分析问题) Na2SO3变质的原因是:_______________________。(用化学方程式表示)
(2) (作出猜想)
猜想1:没有变质,成分是Na2SO3;
猜想 2:完全变质,成分是Na2SO4;
猜想3:_____________。
(实验探究Ⅰ)甲、乙两组分别进行实验探究溶液是否变质:
小组 | 实验操作 | 现象 | 结论 |
甲组 | 取少量样品于试管中加入过量稀盐酸; | 产生气泡 | 没有变质,还是Na2SO3 |
乙组 | 取少量样品于试管中加入氯化钡溶液,再加入足量稀盐酸。 | 产生白色沉淀后 ________ | 已部分变质 |
甲组同学实验中发生的化学方程式为:________________________。有同学质疑甲组方案不合理,理由是_________________。
(3) (实验探究Ⅱ)甲组设计如下实验装置测定Na2SO3溶液的溶质质量分数。(已![]() )
)

①要测定Na2SO3溶液的溶质质量分数,实验中需要测得的数据是亚硫酸钠溶液样品的质量以及_______质量。
②D装置的作用为______________________________。