题目内容
【题目】同学们在学完酸的化学性质后,做了如下实验:
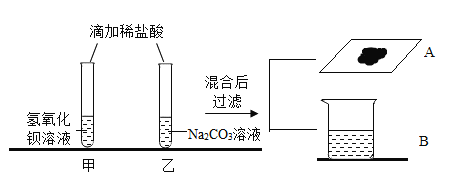
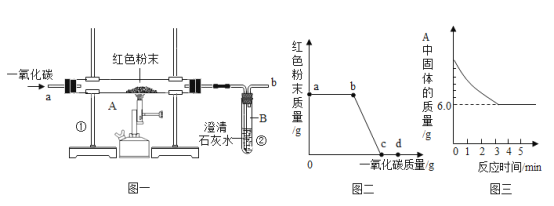
[观察与讨论1]乙试管中观察到_____现象,小组的同学们将实验后溶液混合起来对废液进行处理,混合过程中产生气泡,于是小组同学得出反应后甲试管中的溶质是_____,充分反应后过滤,得到滤液B和滤渣A,向滤渣中加稀硝酸,发现固体表面产生气泡,同学们接着对滤液B中的成分进行探究。
[提出问题1]滤液B中的含有哪些离子?
[猜想与假设]小欣同学猜想:Na+、Cl-
小研同学猜想:Na+、Cl-、SO42-
小洋同学猜想:Na+、Cl-、Ba2+、H+
你的猜想_____(一种即可)
[实验与探究]小研同学认为不需要证明就可得出_____的结论是错误的。
小研同学为证明自己猜想正确,取滤液少量加入足量的氯化钡溶液,发现溶液中产生白色沉淀,继续加入足量稀盐酸,一段时间后观察,固体不消失,则证明自己结论正确。请你对她的结论进行评价_____。
为了进一步证明滤液中离子成分,小群同学取滤液少量加入_____,根据产生的现象即可得出滤液中的离子成分。
[归纳总结]通过以上实验我们能够总结出,在研究反应后溶液中离子成分时,首先应该根据实验现象判断出_____的离子是一定不存在的。在探究过程中,加入试剂后,对物质在_____的现象,进行系统地、细致地观察和描述,得出可靠的结论。
【答案】溶液中产生气泡 氯化钡、氯化氢或BaCl2、HCl Na+、Cl-、Ba2+或者Na+、Cl-、CO32-或者Na+、Cl-、CO32-、SO42- 小洋 不正确,实验中只观察固体是否消失,没有观察是否产生气泡的现象,固体不消失只能证明含有硫酸根离子,不能确定是否含有碳酸根离子。 稀盐酸(或稀硫酸、稀硝酸或酚酞溶液) 与已确定存在的物质能反应 变化前,变化中,变化后或整个实验(过程)中
【解析】
[观察与讨论1]乙试管中滴加硫酸,硫酸和碳酸钠反应生成硫酸钠二氧化碳和水,故现象有气体生成,小组同学们将实验后溶液混合起来对废液进行处理,混合过程中产生气泡,说明甲试管中稀盐酸过量,乙试管中碳酸钠过量,甲试管中盐酸和氢氧化钡生成氯化钡和水,盐酸过量的话,反应后甲试管中的溶质是氯化钡、氯化氢,故填:溶液中产生气泡;氯化钡、氯化氢。
[猜想与假设]甲乙混合充分反应后过滤,得到滤液B和滤渣A,向滤渣中加稀硝酸,发现固体表面产生气泡,说明滤渣中既有硫酸钡又有碳酸钠,滤渣中有碳酸钡,则滤液一定不显酸性一定不含氢离子,因为稀盐酸中的氯离子和碳酸钠中的钠离子既不能转变为沉淀也不能转变为气体,故滤液中一定有钠离子和氯离子,钡离子和硫酸根离子碳酸根离子不能共存,有钡离子就不能存在碳酸根离子和硫酸根离子,故滤液的可能组成为;Na+、Cl-、Ba2+或Na+、Cl-、CO32-或Na+、Cl-、CO32-、SO42-故填:Na+、Cl-、Ba2+或者Na+、Cl-、CO32-或者Na+、Cl-、CO32-、SO42- 。
[实验与探究]因为滤液中不可能含有氢离子,所以不需要证明就可得出小洋的结论是错误的。小研同学为证明自己猜想正确,取滤液少量加入足量的氯化钡溶液,发现溶液中产生白色沉淀,继续加入足量稀盐酸,一段时间后观察,固体不消失,认为自己的结论正确,这种观点不正确,实验中只观察固体是否消失,没有观察是否产生气泡的现象,固体不消失只能证明含有硫酸根离子,不能确定是否含有碳酸根离子,为了进一步证明滤液中是否有碳酸根离子,小群同学取滤液少量加入稀盐酸,观察是否有气泡生成,进而判断是否有碳酸根离子,故填:小洋;不正确,实验中只观察固体是否消失,没有观察是否产生气泡的现象,固体不消失只能证明含有硫酸根离子,不能确定是否含有碳酸根离子;稀盐酸。
[归纳总结]通过以上实验我们能够总结出,在研究反应后溶液中离子成分时,首先应该根据实验现象判断出与已确定存在的物质能反应的离子是一定不存在的。在探究过程中,加入试剂后,对物质在变化前,变化中,变化后或整个实验(过程)中,的现象,进行系统地、细致地观察和描述,得出可靠的结论,故填:与已确定存在的物质能反应;变化前,变化中,变化后或整个实验(过程)中。

【题目】元素周期表中,同周期元素的结构和性质呈现一定的规律性变化。下表列出的是第三周期元素的原子半径及主要化合价(部分信息未列出)。下列有关说法不正确的是( )
元素 | Na | Mg | ① | Si | P | ② | Cl |
原子的最外层电子数 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
原子半径(10-10m) | 1.86 | 1.60 | 1.43 | ③ | 1.10 | 10.2 | 0.994 |
最高正价最低负价 | +1 | +2 | ④ | +4 -4 | +5 -3 | ⑤ | +7-1 |
A.⑤处的最高正价是+6,最低负价是-2
B.元素①的原子序数是 13,①和②形成的化合物的化学式为 AlS
C.第三周期元素(Na→Cl)的最高正价数等于其原子的最外层电子数
D.③处的数值介于 1.10~1.43 之间