题目内容
【题目】某化学兴趣小组的同学,通过咨询老师准备用亚硫酸钠溶液与浓硫酸反应来制备一定量的SO2(Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H 2O),老师给他们提供了一瓶久置的亚硫酸钠溶液,兴趣小组的同学分成甲、乙两小组对该瓶亚硫酸钠溶液成分进行实验探究。
(查阅资料)
① Na2SO3不稳定,在空气中易被氧气氧化成Na2SO4;
②SO32-、SO42-均能与Ba2+反应产生白色沉淀;
③BaSO3 等亚硫酸盐能与稀盐酸反应,其反应原理与 BaCO3等碳酸盐与稀盐酸反应类似。
(1)(提出问题)①该瓶溶液中溶质的成分是什么?
②该瓶溶液中亚硫酸钠的质量分数是多少?
(分析问题) Na2SO3变质的原因是:_______________________。(用化学方程式表示)
(2) (作出猜想)
猜想1:没有变质,成分是Na2SO3;
猜想 2:完全变质,成分是Na2SO4;
猜想3:_____________。
(实验探究Ⅰ)甲、乙两组分别进行实验探究溶液是否变质:
小组 | 实验操作 | 现象 | 结论 |
甲组 | 取少量样品于试管中加入过量稀盐酸; | 产生气泡 | 没有变质,还是Na2SO3 |
乙组 | 取少量样品于试管中加入氯化钡溶液,再加入足量稀盐酸。 | 产生白色沉淀后 ________ | 已部分变质 |
甲组同学实验中发生的化学方程式为:________________________。有同学质疑甲组方案不合理,理由是_________________。
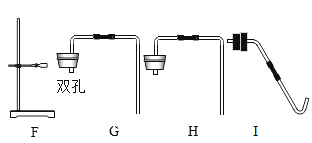
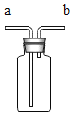
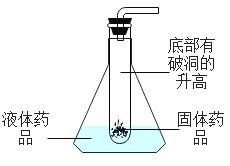
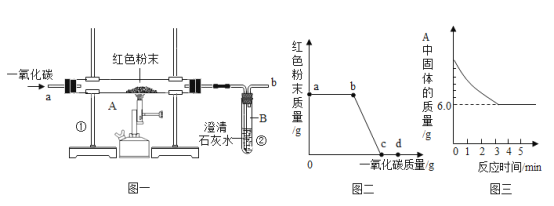
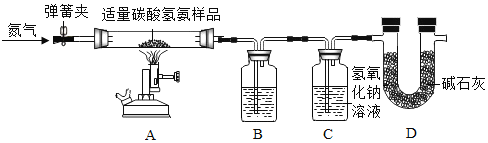
(3) (实验探究Ⅱ)甲组设计如下实验装置测定Na2SO3溶液的溶质质量分数。(已![]() )
)

①要测定Na2SO3溶液的溶质质量分数,实验中需要测得的数据是亚硫酸钠溶液样品的质量以及_______质量。
②D装置的作用为______________________________。
【答案】![]() Na2SO3和Na2SO4 产生气泡
Na2SO3和Na2SO4 产生气泡 ![]() 部分变质的溶液中溶质为硫酸钠和亚硫酸钠,也能与稀盐酸反应产生气泡 反应前、后C装置 防止空气中的二氧化碳和水蒸气进入C装置,影响实验结果
部分变质的溶液中溶质为硫酸钠和亚硫酸钠,也能与稀盐酸反应产生气泡 反应前、后C装置 防止空气中的二氧化碳和水蒸气进入C装置,影响实验结果
【解析】
分析问题:Na2SO3变质,是因为亚硫酸钠与空气中的氧气反应生成了硫酸钠,该反应的化学方程式为:![]() ;
;
作出猜想:亚硫酸钠与空气中的氧气反应生成了硫酸钠,如果亚硫酸钠完全变质,则溶质的成分是硫酸钠,如果未变质,则溶质的成分是亚硫酸钠,如果部分变质,则溶质的成分是硫酸钠和亚硫酸钠,故猜想3为:Na2SO3和Na2SO4;
实验探究Ⅰ:乙组:实验结论为部分变质,则溶质的成分是Na2SO3和Na2SO4,加入氯化钡溶液,氯化钡能与硫酸钠反应生成硫酸钡和氯化钠,亚硫酸钠能与氯化钡反应生成亚硫酸钡和氯化钠,有白色沉淀产生,再加入稀盐酸,亚硫酸钡与稀盐酸反应生成氯化钡、二氧化硫和水,有气泡产生,故实验现象为:产生白色沉淀后产生气泡;
亚硫酸钠能与稀盐酸反应生成氯化钠、二氧化硫和水,该反应的化学方程式为:![]() ;
;
部分变质的溶液中溶质为硫酸钠和亚硫酸钠,亚硫酸钠也能与稀盐酸反应生成氯化钠、二氧化硫和水,有气泡产生,故填:部分变质的溶液中溶质为硫酸钠和亚硫酸钠,也能与稀盐酸反应产生气泡;
(3)实验探究Ⅱ:①![]() ,反应生成的气体通过浓硫酸,浓硫酸可以吸收水分,然后通入足量的氢氧化钠,
,反应生成的气体通过浓硫酸,浓硫酸可以吸收水分,然后通入足量的氢氧化钠,![]() ,反应生成的二氧化硫被氢氧化钠吸收,故C装置增加的质量就是反应生成的二氧化硫的质量,可根据二氧化硫的质量计算出亚硫酸钠的质量,继而求出Na2SO3溶液的溶质质量分数,故还需要测得的数据是反应前、后C装置的质量;
,反应生成的二氧化硫被氢氧化钠吸收,故C装置增加的质量就是反应生成的二氧化硫的质量,可根据二氧化硫的质量计算出亚硫酸钠的质量,继而求出Na2SO3溶液的溶质质量分数,故还需要测得的数据是反应前、后C装置的质量;
(4)D装置内为碱石灰,碱石灰可以吸收空气中的水蒸气和二氧化碳,防止其进入C装置,影响实验结果,故填:防止空气中的二氧化碳和水蒸气进入C装置,影响实验结果。

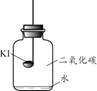
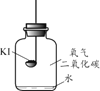
【题目】碘化钾(KI)保存不当会变质。实验小组进行以下实验探究KI变质的因素。
【提出问题】 KI变质的条件是什么?
【查阅资料】
① KI为白色粉末,暴露在空气中或久置会被氧化为碘(I2)而泛黄变质。
② 碘水中含较多KI时,滴加淀粉溶液显紫色或蓝紫色
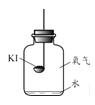
【进行实验】分别取适量KI于燃烧匙中,再分别放入盛有不同物质的集气瓶中,塞紧胶塞,若干天后观察。
实验1 | 实验2 | 实验3 | 实验4 |
|
|
|
|
固体变潮、表面变微黄 | 固体无明显现象 | 固体变潮、无其他明显现象 | 固体变潮、表面变黄 |
继续实验:取实验1中少量微黄固体溶解,加入淀粉溶液,溶液变紫色。
取实验4中少量黄色固体溶解,加入淀粉溶液,溶液变紫色。
【解释与结论】
(1)实验3的目的是_______。
(2)对比实验_______,可以得出KI变质一定与水有关。
(3)从上述实验可推知,KI变质的条件是_______。
【提出问题2】CO2的作用是什么?
【进行实验】分别取10 mL同浓度的KI溶液于3支试管中,再向试管2中通入CO2,向试管3中滴加几滴盐酸;分别测溶液的pH;几分钟后,观察溶液的颜色;再向试管中滴入淀粉溶液,观察溶液的颜色。实验现象记录如下:
试管序号 | 1 | 2 | 3 |
溶液pH | pH=8.5 | pH=6.5 | pH=4.5 |
溶液颜色 | 无色 | 浅黄色 | 黄色 |
滴加淀粉溶液后的颜色 | 无色 | 紫色 | 深紫色 |
较长时间后,观察到试管1中溶液变为紫色。
【解释与结论】
(4)试管1实验的目的是_______。
(5)CO2在KI变质过程中的作用是_______。
【反思与评价】
(6)探究KI变质条件时,同学们排除了氮气和稀有气体的影响,其原因是______。