题目内容
【题目】现有FeCO3和CuO的混合物31.2g,进行如下实验,把混合物全部加入到100g适量的硫酸溶液中,恰好完全反应溶解,然后滴加适量的质量分数为16%的氢氧化钠溶液,直到恰好不再有沉淀生成,共用去150g 氢氧化钠溶液,混合物中FeCO3的质量分数为( )
A.30%B.74.4%C.70%D.25.6%
【答案】B
【解析】
根据题意,FeCO3和CuO的混合物31.2g,和100g适量的硫酸溶液恰好完全反应,生成的硫酸亚铁和硫酸铜与150g16%的氢氧化钠溶液恰好完全反应。
设混合物中FeCO3质量为x,则CuO的质量为31.2g-x;设与硫酸亚铁反应的氢氧化钠质量为y,则与硫酸铜反应的氢氧化钠质量为150g×16%-y。
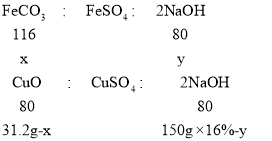
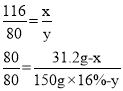
解得x=23.2g
则混合物中FeCO3的质量分数为:![]() 。故选B。
。故选B。

 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案【题目】碘化钾(KI)保存不当会变质。实验小组进行以下实验探究KI变质的因素。
【提出问题】 KI变质的条件是什么?
【查阅资料】
① KI为白色粉末,暴露在空气中或久置会被氧化为碘(I2)而泛黄变质。
② 碘水中含较多KI时,滴加淀粉溶液显紫色或蓝紫色
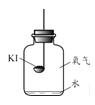
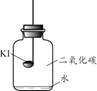
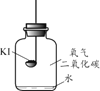
【进行实验】分别取适量KI于燃烧匙中,再分别放入盛有不同物质的集气瓶中,塞紧胶塞,若干天后观察。
实验1 | 实验2 | 实验3 | 实验4 |
|
|
|
|
固体变潮、表面变微黄 | 固体无明显现象 | 固体变潮、无其他明显现象 | 固体变潮、表面变黄 |
继续实验:取实验1中少量微黄固体溶解,加入淀粉溶液,溶液变紫色。
取实验4中少量黄色固体溶解,加入淀粉溶液,溶液变紫色。
【解释与结论】
(1)实验3的目的是_______。
(2)对比实验_______,可以得出KI变质一定与水有关。
(3)从上述实验可推知,KI变质的条件是_______。
【提出问题2】CO2的作用是什么?
【进行实验】分别取10 mL同浓度的KI溶液于3支试管中,再向试管2中通入CO2,向试管3中滴加几滴盐酸;分别测溶液的pH;几分钟后,观察溶液的颜色;再向试管中滴入淀粉溶液,观察溶液的颜色。实验现象记录如下:
试管序号 | 1 | 2 | 3 |
溶液pH | pH=8.5 | pH=6.5 | pH=4.5 |
溶液颜色 | 无色 | 浅黄色 | 黄色 |
滴加淀粉溶液后的颜色 | 无色 | 紫色 | 深紫色 |
较长时间后,观察到试管1中溶液变为紫色。
【解释与结论】
(4)试管1实验的目的是_______。
(5)CO2在KI变质过程中的作用是_______。
【反思与评价】
(6)探究KI变质条件时,同学们排除了氮气和稀有气体的影响,其原因是______。
【题目】某化学兴趣小组的同学,为了比较金属 R 与铁、铜的金属活动性强弱,进行如下探究活动:
(査阅资料)铁的活动性比铜强。
(进行猜想)对三种金属的活动性顺序做出如下猜想: 猜想一:R>Fe>Cu;猜想二:_______________; 猜想三:Fe>Cu>R。
(收集证据)为了验证哪一种猜想成立,甲、乙、丙三位同学分别展开实验探究。
主要操作 | 主要现象 | 实验结论 | ||
甲 | 将打磨好的R 丝插入盛有硫酸铜溶液的试管中 | ____________ | 猜想一正确 | |
乙 | 将粗细相同打磨好的 R 丝、铁丝,分别插入体积和溶质质量分数都相同的稀盐酸中 | R 丝表面产生气泡速率比铁丝表面产生气泡速率_____________( 填 “快”或“慢”) | ||
丙 | 将粗细相同打磨好的 R 丝、铁丝,分别在空气中点燃 | R 丝在空气中剧烈燃烧,铁丝在空气中_______________ | ||
写出铁丝在氧气中燃烧的化学方程式:________________。
(交流反思)三位同学交流讨论后认为,比较金属活动性强弱的方法有多种。
(归纳总结)他们总结得出比较金属活动性强弱的常见方法有:
(1)金属与氧气反应的难易和剧烈程度;
(2)金属与酸溶液是否反应或反应的剧烈程度;
(3)金属与______________是否反应。
【题目】元素周期表中,同周期元素的结构和性质呈现一定的规律性变化。下表列出的是第三周期元素的原子半径及主要化合价(部分信息未列出)。下列有关说法不正确的是( )
元素 | Na | Mg | ① | Si | P | ② | Cl |
原子的最外层电子数 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
原子半径(10-10m) | 1.86 | 1.60 | 1.43 | ③ | 1.10 | 10.2 | 0.994 |
最高正价最低负价 | +1 | +2 | ④ | +4 -4 | +5 -3 | ⑤ | +7-1 |
A.⑤处的最高正价是+6,最低负价是-2
B.元素①的原子序数是 13,①和②形成的化合物的化学式为 AlS
C.第三周期元素(Na→Cl)的最高正价数等于其原子的最外层电子数
D.③处的数值介于 1.10~1.43 之间