题目内容
【题目】某化学课堂围绕“酸碱中和反应”,将学生分成若干小组,在老师引导下开展探究活动。以下是教学片段,请你参与学习并帮助填写空格(包括表中空格)。
(演示实验)将一定量的稀H2SO4加入盛有NaOH溶液的小烧杯中。
(学生板演)该反应的化学方程式________________。
(提出问题)实验未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质是什么?
(猜想假设)针对疑问,大家纷纷提出猜想。甲组同学的猜想如下:猜想一:只有Na2SO4;猜想二:有____________ ;猜想三:有Na2SO4和NaOH;猜想四:有Na2SO4、H2SO4和NaOH。乙组同学对以上猜想提出质疑,认为有一种猜想是不合理的。不合理的猜想及其理由是_________。
(实验探究)
(1)丙组同学取烧杯中的溶液少量于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有____________。
(2)为了验证其余猜想,各学习小组利用烧杯中的溶液,并选用老师提供的pH试纸、铜片、BaCl2溶液、Na2CO3溶液,进行如下三个方案的探究。
实验方案 | 测溶液pH | 滴加Na2CO3溶液 | 滴加BaCl2溶液 |
实验操作 |
|
|
|
实验现象 | 试纸变色,对比比色卡,pH____7(选填“>”“<”或“=”) | _________ | 产生白色沉淀 |
实验结论 | 溶液中有H2SO4 | 溶液中有 H2SO4 | 溶液中有H2SO4 |
(得出结论)通过探究,全班同学一致确定猜想二是正确的。
(评价反思)老师对同学们用多种方法进行探究,并得出正确结论给予肯定。同时指出实验探究(2)中存在两处明显错误,请大家反思。同学们经过反思发现了两处错误:
(1)实验操作中的错误是 __________________ 。
(2)实验方案中有一个是错误的,写出能说明实验方案错误原因的化学方程式是 _______________。
【答案】H2SO4+2NaOH=Na2SO4+2H2O Na2SO4和H2SO4 猜想四不正确,H2SO4和NaOH还会继续反应 NaOH或氢氧化钠 < 有气泡产生 pH试纸浸入溶液中 BaCl2+Na2SO4=BaSO4↓+2NaCl
【解析】
氢氧化钠和稀硫酸反应生成硫酸钠和水,该反应的化学方程式为:![]() ;
;
提出问题:
实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质是什么呢?
假设猜想:
氢氧化钠与稀硫酸要么恰好完全反应,要么其中一种有剩余,所以猜想二就是Na2SO4和H2SO4;
不合理的猜想是猜想四,理由是硫酸和氢氧化钠不能共存;
实验探究(1):
丙组同学取烧杯中的溶液少量于试管中,滴加几滴cuso4溶液,无明显变化,说明溶液中一定没有氢氧化钠,这是因为如果含有氢氧化钠时会和硫酸铜反应生成蓝色沉淀;
实验探究(2): 实验过程如下所示:
实验方案 | 测溶液pH | 滴加Na2CO3溶液 | 滴加BaCl2溶液 |
实验操作 |
|
|
|
实验现象 | 试纸变色,对比比色卡,pH < 7(选填“>”“<”或“=”) | 产生气泡 | 产生白色沉淀 |
实验结论 | 溶液中有H2SO4 | 溶液中有H2SO4 | 溶液中有H2SO4 |
评价反思:
(1)实验操作中的错误是将PH试纸直接伸入待测溶液中,因为这样会污染试剂;
(2)实验方案中也有一个是错误的,错误的是把氯化钡溶液加入溶液中,错误原因是硫酸钠也可以和氯化钡反应产生白色沉淀,因此产生白色沉淀不能说明溶液中含有硫酸。
方程式为:![]() 。
。

 期末宝典单元检测分类复习卷系列答案
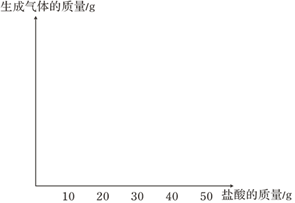
期末宝典单元检测分类复习卷系列答案【题目】四位同学元旦去礐石风景区游玩,带回了几小块石灰石样品。为了检测样品中碳酸钙的含量,甲、乙、丙、丁四位同学用浓度相同的盐酸与样品充分反应来进行实验测定,(样品中的杂质不溶于水,且不与盐酸反应)测定数据如下:
甲同学 | 乙同学 | 丙同学 | 丁同学 | |
所取石灰石样品质量(g) | 10.0 | 10.0 | 10.0 | 10.0 |
加入盐酸的质量(g)烧杯中 | 10.0 | 20.0 | 30.0 | 40.0 |
剩余物质的总质量(g) | 19.0 | 28.0 | 37.0 | 46.7 |
试回答:
(1)四位同学里面,______同学的实验样品完全反应;10.0g石灰石样品与 _______g盐酸恰好完全反应。
(2)求样品中碳酸钙的质量分数为___________(写出计算过程)。
(3)请在图中画出加入稀盐酸的质量与生成气体的质量的变化关系(标注必要的数值)。
 ___________
___________
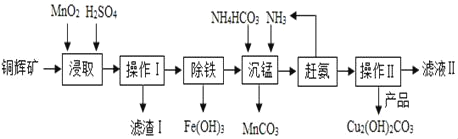
【题目】平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)。某课题以此粉末为原料,设计如下工艺流程对资源进行回收,得到Ce(OH)4和硫酸铁铵:

已知:1.SiO2+2NaOH=Na2SiO3+H2O
2.CeO2是一种金属氧化物,化学性质稳定,与稀硫酸不反应。在H2O2存在的条件下,两种物质能反应。
3.硫酸铁铵矾[Fe2(SO4)32(NH4)2SO43H2O]广泛用于水的净化处理.
(1)氧化铈(CeO2)中,铈的化合价为____________,检验硫酸铁铵溶液中含有NH4+的方法是:__________。
(2)为提高①中硫酸的反应效率,可采用的具体措施有_____________。(写一种即可)。
(3)操作应为_____________。
(4)反应①之前先要洗涤滤渣B,其目的是为了除去_____________(填离子符号)。
(5)请补充完整①反应的化学方程式:2CeO2+3H2SO4+H2O2=Ce2(SO4)3+_____+ ____↑。
(6)碲(Te)被誉为“现代工业、国防与尖端技术的维生素,创造人间奇迹的桥梁”。实验室模拟提取碲的一个实验是:取某含碲溶液于烧瓶中,加入适量的NaCl,加热到一定温度,持续通入SO2,待反应一段时间,过滤得到粗碲。反应方程式为TeOSO4 +2SO2+3H2O![]() Te↓+ 3H2SO4,为探究获得较高粗碲沉淀率的反应条件,某研究小组在控制NaCl浓度和SO2流量不变的条件下,进行下述对比实验,数据如下:
Te↓+ 3H2SO4,为探究获得较高粗碲沉淀率的反应条件,某研究小组在控制NaCl浓度和SO2流量不变的条件下,进行下述对比实验,数据如下:
实验 | 温度/℃ | 反应时间 | 粗碲沉淀率/% |
a | 65 | 3.0 | 65.0 |
b | 80 | 3.0 | 98.9 |
c | 80 | 2.0 | 98.9 |
d | 90 | 2.0 | 97.0 |
① a和b的结论是______________。
②为了提升设备利用效率和节约能源,可进一步优化反应条件测定粗确沉淀率。若再设计对比实验,选择的反应条件还可以是_________。
A80℃,1.5h B80℃,2.5h C70℃,