��Ŀ����
����Ŀ�����������װ��,�ش�����:
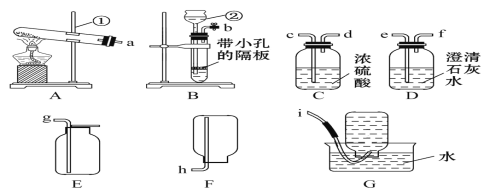
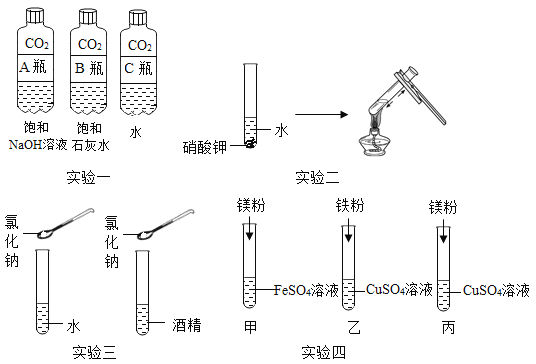
��1��д����Ţ٢ڵ���������:��________,��________��
��2��ʵ����������غͶ������̵Ļ������ȡ���ռ����������ʱ������ͼ��ѡ�õ�װ������Ϊ______________(�����)��
��3��ʵ����Ҫ��ȡ������̼Ӧѡ��ķ���װ����B�������ŵ���____________,��Ӧ�Ļ�ѧ����ʽ��___________________. ��Ҫ���鲢�õ�һƿ����Ķ�����̼����,����������ӿ�����˳��Ϊ��_______��
A b��e��f��c��d��g B b��c ��d��e��f��g
C b��f��e��d��c��g D b��d��c��f��e��g
���𰸡�����̨ ����©�� ACE ���Կ��Ʒ�Ӧ�Ŀ�ʼ����� CaCO3+2HCl�TCaCl2+H2O+CO2�� A
��������
��1����������̨���ڳ���©����
��2��ʵ����������غͶ������̵Ļ������ȡ���������ڹ̡��̼����ͣ��ʺ���װ��A������װ�ã��������ܶȱȿ�����Ҫ�ռ��������������ѡ��װ��C�������װ��E�ռ�����ͼ��ѡ�õ�װ������ΪACE��
��3��ʵ������ȡ������̼һ��ѡ�ô���ʯ��ʯ��ʯ��ϡ���ᷴӦ�����ڹ̡�Һ�������ͣ�Ӧѡ��ķ���װ����B�����ر�ֹˮ�У��Թ����������࣬ѹǿ����ϡ����ѹ�س���©����ʯ��ʯ�����ʯ��ϡ������룬��Ӧֹͣ�����ٴ�ֹˮ��ʱ�������ص������ܳ����Թ���������٣�ѹǿ��С������©����ϡ�����½�����ʯ��ʯ�����ʯ�Ӵ�����Ӧ�������У����Ը�װ�õ��ŵ��ǣ��ܹ����Ʒ�Ӧ�Ŀ�ʼ�������̼��ƺ�ϡ���ᷴӦ�����Ȼ��ơ�ˮ�Ͷ�����̼����ѧ����ʽΪ��![]() �����ڹ̡�Һ�����ͣ��ʺ���װ��B������װ�ã�������̼���ܶȱȿ�����������ˮ��Ҫ���鲢�ռ�����Ķ�����̼�������ó���ʯ��ˮ���飬����Ũ������Ȼ�����������ſ������ռ�����ȷ��˳��Ϊ��b��e��f��c��d��g����ѡA��
�����ڹ̡�Һ�����ͣ��ʺ���װ��B������װ�ã�������̼���ܶȱȿ�����������ˮ��Ҫ���鲢�ռ�����Ķ�����̼�������ó���ʯ��ˮ���飬����Ũ������Ȼ�����������ſ������ռ�����ȷ��˳��Ϊ��b��e��f��c��d��g����ѡA��

����Ŀ����������������������������Ҫ��Դ��
��������⣩�����ǵ�ȼ�ղ�����CO2��H2O���ɴ��ܷ�֤����������ֻ��̼Ԫ�غ���Ԫ����ɵ��л��
��ʵ����ƣ�Ϊ��ȷ�������ǵ�Ԫ����ɣ�ijС���������ͼ��ʵ�����̣�����Ũ���ᡢ��ˮCaCl2��Ϊ���ø���������̶ֹ�װ��ʡ�ԣ���
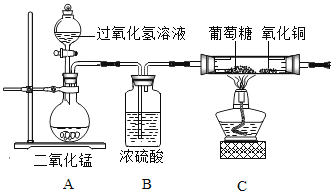
��1��װ��B��Ũ�����������__________________��
��2��װ��C������ͭ��������_________________��
���������ۣ�
��1���ó��п����Ĵ��������װ��A���Ƿ��������ʵ��Ľ��У�________����ǡ���ԭ����______________��
��2��װ��D��E______________����ܡ����ܡ����Ե���ԭ����_____________��
�����ݴ������±�3��ͬѧ����д��ʵ�鱨�棬���������ɡ�
ʵ����ʵ | ���ݷ��������� |
1.8g��������ȫȼ�գ��õ�2.64g CO2��1.08g H2O | ����___________ ���ۣ������Ǻ���C��H��O����Ԫ�� |
�����۽�����Ϊ�˾���������
��1����ʵ���ڽ��й�����Ӧע���������________________��д1������
��2���Ӷ���ʵ��ĽǶȿ�����ʵ���Ƿ�ɽ�һ���Ľ������Ҫд��һ���Ľ������___________��
����Ŀ��ʵ������һƿ��ǩ��ȱ����ƿ��û����ȫ�ܷ����ɫ��Һ������ͼ����Ϊȷ�����е����ʣ�ͬѧ�ǽ��������µ�̽�����������뵽����ȥ���ش��й����⡣

�����в��롿�������Һ��������NaCl��
�������Һ��������NaOH��
�������Һ��������Na2CO3��
����IV������Һ��������NaHCO3.
���������ϡ����������ʵ������Ϣ���±���
���� | NaCl | NaOH | Na2CO3 | NaHCO3 |
�����µ��ܽ��/g | 36 | 109 | 21.5 | 9.6 |
������ϡ��Һ��pH | 7 | 13 | 11 | 9 |
�����ʵ������Ϣ��֪������Һ�����ʲ���NaHCO3����Ϊ������NaHCO3��Һ���ʵ��������������
����ȷ��01.%����
������ʵ�顿
��1���ⶨ��Һ��pH����7������Һ�����ʲ��� ���ѧʽ����
��2��ͬѧ���ֽ���������ʵ�飬ʵ��������£�

��������ɫ�����Ļ�ѧ����ʽ�� ��
��ʵ������ж�ԭ��ɫ��Һ�к��е������� ��
����ý��ۡ�
��ƿԭ��װ����ɫ��Һ��������NaOH������ ���û�С��������֡���ȫ���������ʡ�
����չ��
�ᴿ����ɫ��Һ�IJ����ǣ�������ɫ��Һ�м��������� ��Ȼ����ˡ���Ӧ��ѧ����ʽ�� ��
����Ŀ��ij��ѧ����Χ�ơ�����кͷ�Ӧ��,��ѧ���ֳ�����С��,����ʦ�����¿�չ̽����������ǽ�ѧƬ��,�������ѧϰ��������д�ո�(�������пո�)��
����ʾʵ�飩��һ������ϡH2SO4����ʢ��NaOH��Һ��С�ձ��С�
��ѧ�����ݣ��÷�Ӧ�Ļ�ѧ����ʽ________________��
��������⣩ʵ��δ�۲쵽��������,����ͬѧ����������:��Ӧ����Һ��������ʲô?
��������裩�������,��ҷ�������롣����ͬѧ�IJ������£�����һ:ֻ��Na2SO4�������:��____________ ��������:��Na2SO4��NaOH��������:��Na2SO4��H2SO4��NaOH������ͬѧ�����ϲ����������,��Ϊ��һ�ֲ����Dz������ġ��������IJ��뼰��������_________��
��ʵ��̽����
��1������ͬѧȡ�ձ��е���Һ�������Թ���,�μӼ���CuSO4��Һ,�����Ա仯,��Һ��һ��û��____________��
��2��Ϊ����֤�������,��ѧϰС�������ձ��е���Һ,��ѡ����ʦ�ṩ��pH��ֽ��ͭƬ��BaCl2��Һ��Na2CO3��Һ,������������������̽����
ʵ�鷽�� | ����ҺpH | �μ�Na2CO3��Һ | �μ�BaCl2��Һ |
ʵ����� |
|
|
|
ʵ������ | ��ֽ��ɫ,�Աȱ�ɫ��,pH____7(ѡ�>����<����=��) | _________ | ������ɫ���� |
ʵ����� | ��Һ����H2SO4 | ��Һ���� H2SO4 | ��Һ����H2SO4 |
���ó����ۣ�ͨ��̽��,ȫ��ͬѧһ��ȷ�����������ȷ�ġ�
�����۷�˼����ʦ��ͬѧ���ö��ַ�������̽��,���ó���ȷ���۸���϶���ͬʱָ��ʵ��̽����2���д����������Դ���,���ҷ�˼��ͬѧ�Ǿ�����˼��������������:
��1��ʵ������еĴ����� __________________ ��
��2��ʵ�鷽������һ���Ǵ����,д����˵��ʵ�鷽������ԭ��Ļ�ѧ����ʽ�� _______________��