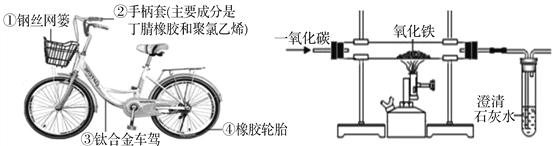
题目内容
【题目】四位同学元旦去礐石风景区游玩,带回了几小块石灰石样品。为了检测样品中碳酸钙的含量,甲、乙、丙、丁四位同学用浓度相同的盐酸与样品充分反应来进行实验测定,(样品中的杂质不溶于水,且不与盐酸反应)测定数据如下:
甲同学 | 乙同学 | 丙同学 | 丁同学 | |
所取石灰石样品质量(g) | 10.0 | 10.0 | 10.0 | 10.0 |
加入盐酸的质量(g)烧杯中 | 10.0 | 20.0 | 30.0 | 40.0 |
剩余物质的总质量(g) | 19.0 | 28.0 | 37.0 | 46.7 |
试回答:
(1)四位同学里面,______同学的实验样品完全反应;10.0g石灰石样品与 _______g盐酸恰好完全反应。
(2)求样品中碳酸钙的质量分数为___________(写出计算过程)。
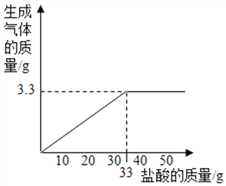
(3)请在图中画出加入稀盐酸的质量与生成气体的质量的变化关系(标注必要的数值)。
 ___________
___________
【答案】 丁 33.0 75.0% 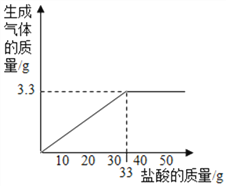
【解析】解:(1)①由图表可知,四位同学所取样品的质量相等,减少的质量为生成二氧化碳的质量,每增加10.0g盐酸固体的质量减少1.0g;而丁同学加入 40.0g盐酸与10.0g样品反应,固体质量只减少了3.3g,说明40.0g盐酸未完全反应,样品完全反应;10.0g样品与盐酸恰好完全反应需要盐酸的质量为![]() ×10.0g=33.0g;
×10.0g=33.0g;
(2)样品中碳酸钙的质量为x,
CaCO3+2HCl═CaCl2+CO2↑+H2O
100 44
x 3.3g
![]()
x=7.5g
样品中碳酸钙的质量分数为: ![]() ×100%=75.0%。
×100%=75.0%。
(3)根据题意可得:加入稀盐酸的质量与生成气体的质量的变化关系图如下:
 。
。

【题目】某校研究性学习小组的同学设计了一个对比实验,探究物质溶于水时是放出热量还是吸收热量。向下图A、B、C三个实验装置中盛有一定量水的小试管里依次加入固体NaCl、NH4NO3、NaOH(加入固体物质之前,三个实验装置中U形管两端的液面持平)。
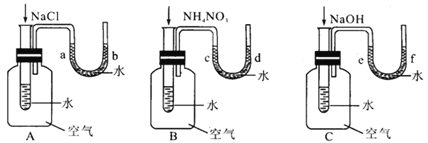
(1)请你帮他们填写下表。
A | B | C | |
现象 | ___________ | ____________ | ___________ |
原因 | __________ | ____________ | ____________ |
(2)从上述物质溶解于水的对比实验中你得出的初步结论是______________。