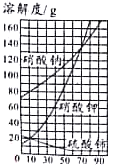
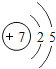题目内容
【题目】下列四个图像的变化趋势,能正确描述对应操作的是( )
A.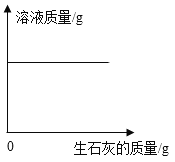 一定温度下,向一定量的饱和石灰水中加入生石灰
一定温度下,向一定量的饱和石灰水中加入生石灰
B.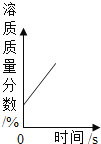 将一定量的浓盐酸敝口放置在空气中
将一定量的浓盐酸敝口放置在空气中
C.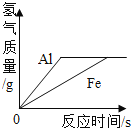 足量的铁片和铝片分别与等质量、等浓度的稀盐酸反应
足量的铁片和铝片分别与等质量、等浓度的稀盐酸反应
D.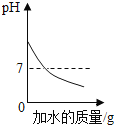 向 pH=13 的氢氧化钠溶液中不断加入水
向 pH=13 的氢氧化钠溶液中不断加入水
【答案】C
【解析】
A、氧化钙能与饱和溶液中的溶剂水反应生成氢氧化钙,导致溶剂减少,则会有氢氧化钙析出,溶液质量会减小,故错误;
B、浓盐酸具有挥发性,易挥发出溶质氯化氢,导致溶质质量分数降低,而图象显示其质量分数增大,故错误;
C、铝的金属活动性比铁强,故反应时铝反应的速度比铁快,而该图象反映铁的反应速度比铝快;由于氢气来自酸中的氢元素,反应的酸相同,生成氢气质量相等,故正确;
D、氢氧化钠溶液中加水稀释,碱性减弱,溶液的pH会变小,但不会小于或等于7,故错误;
故选C。

【题目】寒假期间,某兴趣小组同学对“锌与硫酸反应快慢的影响因素”进行探究。
[提出问题] 锌与硫酸反应的快慢与哪些因素有关?
[猜想假设](1)a、可能与锌的形状、颗粒大小有关;
b、可能与硫酸的质量分数大小有关;
c、还可能与______有关。
[设计与实验] 以3分钟内收集到的氢气体积作为判断依据,具体如下表所示:
实验 编号 | 锌的形状 (均取1 g) | 硫酸的浓度 (均取20 mL) | 氢气的体积 (/mL) |
① | 锌粒 | 20% | 31.7 |
② | 锌片 | 20% | 50.9 |
③ | 锌粒 | 30% | 61.7 |
④ | 锌片 | 30% |
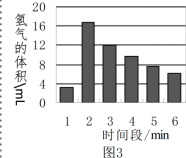
[比较分析](2)要验证猜想a ,可选择的实验编号是_______________。
(3)实验④由于没有及时记下数据,经同学回忆,你认为比较可能的数值是__________(填“57.5”或“75.5”)。
[得出结论](4)完成实验①②③后,可以得出影响该反应快慢的一条结论是:________。
[反思评价] 图3是用实验①来测定,在每一分钟内收到氢气的体积变化图,请
(5)第1分钟时间内反应的速率较慢,这是由于锌粒表面有些氧化膜(ZnO)覆盖,则其原因用化学方程式表示为______。
(6)从第3分钟开始,反应的速率又逐渐变______,这是因为______。
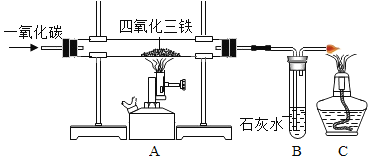
【题目】葡萄糖是生命体所需能量的主要来源。
(提出问题)葡萄糖的燃烧产物是CO2和H2O,由此能否证明:葡萄糖只由碳元素和氢元素组成的有机物?
(实验设计)为了确定葡萄糖的元素组成,某小组设计了如图的实验流程(其中浓硫酸、无水CaCl2均为常用干燥剂,部分固定装置省略)。
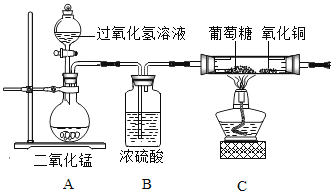
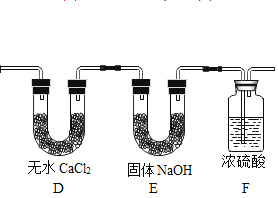
(1)装置B中浓硫酸的作用是__________________。
(2)装置C处氧化铜的作用是_________________。
(方案评价)
(1)用充有空气的储气球代替装置A,是否更有利于实验的进行?________(填“是”或“否”)原因是______________。
(2)装置D和E______________(填“能”或“不能”)对调,原因是_____________。
(数据处理)下表3是同学们填写的实验报告,请你帮助完成。
实验事实 | 数据分析及结论 |
1.8g葡萄糖完全燃烧,得到2.64g CO2和1.08g H2O | 数据___________ 结论:葡萄糖含有C、H、O三种元素 |
(讨论交流)为了尽量减少误差:
(1)该实验在进行过程中应注意的问题是________________(写1条)。
(2)从定量实验的角度看,该实验是否可进一步改进?请简要写出一个改进意见:___________。
【题目】2012年1月,广西河池宜州市境内龙江河发生了镉浓度超标事件。根据该事件某化学活动小组开展了一次关于金属镉与铜、银活动性顺序的探究及镉污染事故处理方法的研讨活动。
查阅资料:①镉(Cd)是一种银白色金属,在化合物中通常表现为+2价 ②水体中镉元素通常以氯化镉的形式存在 ③氯化镉能溶于水,氢氧化镉难溶于水
(一)金属镉与铜、银活动性顺序的探究
实验步骤 | 实验现象 | 实验结论 |
取适量镉、铜、银于试管中,加入足量 | 镉表面有气泡产生,铜、银表面无气泡产生 | 镉的活动性顺序大于铜与银 |
取适量铜于试管中,加入少量硝酸银溶液 | , | 铜的活动性顺序大于银 |
实验结论:活动性顺序:镉>铜>银
(二)对镉污染事故处理方法的讨论
小聪认为可用向受污染河段抛撒过量烧碱固体的方法除去氯化镉,反应原理用化学方程式表示为 。小敏认为该方案虽然有效,但有缺陷,原因是 。受小聪与小敏启发,你认为可以用 (写俗称)代替烧碱。
【题目】某化学课堂围绕“酸碱中和反应”,将学生分成若干小组,在老师引导下开展探究活动。以下是教学片段,请你参与学习并帮助填写空格(包括表中空格)。
(演示实验)将一定量的稀H2SO4加入盛有NaOH溶液的小烧杯中。
(学生板演)该反应的化学方程式________________。
(提出问题)实验未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质是什么?
(猜想假设)针对疑问,大家纷纷提出猜想。甲组同学的猜想如下:猜想一:只有Na2SO4;猜想二:有____________ ;猜想三:有Na2SO4和NaOH;猜想四:有Na2SO4、H2SO4和NaOH。乙组同学对以上猜想提出质疑,认为有一种猜想是不合理的。不合理的猜想及其理由是_________。
(实验探究)
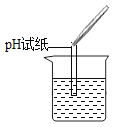
(1)丙组同学取烧杯中的溶液少量于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有____________。
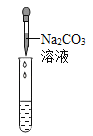
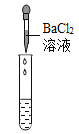
(2)为了验证其余猜想,各学习小组利用烧杯中的溶液,并选用老师提供的pH试纸、铜片、BaCl2溶液、Na2CO3溶液,进行如下三个方案的探究。
实验方案 | 测溶液pH | 滴加Na2CO3溶液 | 滴加BaCl2溶液 |
实验操作 |
|
|
|
实验现象 | 试纸变色,对比比色卡,pH____7(选填“>”“<”或“=”) | _________ | 产生白色沉淀 |
实验结论 | 溶液中有H2SO4 | 溶液中有 H2SO4 | 溶液中有H2SO4 |
(得出结论)通过探究,全班同学一致确定猜想二是正确的。
(评价反思)老师对同学们用多种方法进行探究,并得出正确结论给予肯定。同时指出实验探究(2)中存在两处明显错误,请大家反思。同学们经过反思发现了两处错误:
(1)实验操作中的错误是 __________________ 。
(2)实验方案中有一个是错误的,写出能说明实验方案错误原因的化学方程式是 _______________。