��Ŀ����
����Ŀ��ij�о���ѧϰС������˲ⶨ������Ʒ��ֻ��NaCl���ʣ���̼��������������ʵ�鷽������ش��������⣺
��1��̼������ӳ�������ʵ�鲽�裺
����������ƽ��ȡ��Ʒwg�����ձ��м�ˮ�ܽ⣻
�ڼ�������BaCl2��Һ��ַ�Ӧ��֤����Ӧ��BaCl2ʣ��ķ�����_____��
�۹��ˡ�ϴ�ӡ������������������Ϊmg��
�ܼ����̼���Ƶ��������ټ�����Ʒ��̼���Ƶ�����������
��2��ָʾ����ɫ����ʵ�鲽�裺
����������ƽ��ȡ��Ʒ10.6g�����ձ��м�ˮ�ܽ⣻
�ڵ��뼸�η�̪��Һ��
���õι���������10%��ϡ���ᣬ�����Ͻ��裬����Һ��ɫǡ�ñ�Ϊ��ɫΪֹ������ȥ��ϡ����7.3g����ش�
a����̪��Һ��������_____��
b���ߵμ�ϡ���ᣬ��Ҫ�ò��������Ͻ����Ŀ����_____��
c����Ӧ�Ļ�ѧ����ʽΪ_____��10.6g��Ʒ�к�̼���Ƶ�����Ϊ_____����Ʒ��̼������������Ϊ_____���ðٷ�����ʾ����
��3�����Ȼ��Ʒ��������������ʵ�鷽����
��ȡһЩ��Ʒ�����ձ��м�ˮ�ܽ⣺
�ڼ�������ϡ���ᣬ�ټ�����������������Һ��������������Һʱ������Ӧ�Ļ�ѧ����ʽ�ǣ�_____��
�۹��ˡ�ϴ�ӡ������������������Ϊmg��
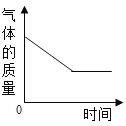
�ܼ�����Ȼ��Ƶ�������������Ʒ��̼���Ƶ�������������ʵ�����ͬѧ���֣����������������Dz��ܼ����̼���Ƶ�����������ԭ����_____��
���𰸡����ã�ȡ�����ϲ���Һ����������̼������Һ���а�ɫ�������ɣ�֤���Ȼ���ʣ�� �ж��Ƿ�ǡ����ȫ��Ӧ ʹ��Ӧ���ֽӴ�����ȫ��Ӧ ![]() 1.06g 10%
1.06g 10% ![]() ��ʼû�г�����Ʒ������
��ʼû�г�����Ʒ������
��������
��1�����Ȼ�������̼���Ʒ�Ӧ����̼�ᱵ�������ʿ��Լ���̼������Һ�۲��Ƿ������ɫ������������ɫ������֤���Ȼ���ʣ�࣬������ã�ȡ�����ϲ���Һ����������̼������Һ���а�ɫ�������ɣ�֤���Ȼ���ʣ�ࣻ
��2����a��̼�����Լ��ԣ���ʹ��ɫ��̪��Һ��죬̼������ϡ���ᷴӦ�����Ȼ��ơ�������̼��ˮ���Ȼ��Ƴ����ԣ�����ʹ��ɫ��̪��Һ��ɫ���ʸ��ݷ�̪��Һ��ɫ�ı仯�жϷ�Ӧ�Ƿ�ǡ����ȫ��Ӧ������ж��Ƿ�ǡ����ȫ��Ӧ��
b�������������ܴٽ����ʼ�ĽӴ����ӿ췴Ӧ�Ľ��У����ʹ��Ӧ���ֽӴ�����ȫ��Ӧ��
c��̼��������ϡ���ᷴӦ�����Ȼ��ơ�ˮ�Ͷ�����̼���÷�Ӧ�Ļ�ѧ����ʽΪ��![]() ��
��
��̼���Ƶ�����Ϊx������

![]() x=1.06g
x=1.06g
��̼���Ƶ���������Ϊ��![]() ��
��
��3���������������Ȼ��Ʒ�Ӧ�����Ȼ��������������ƣ��÷�Ӧ�Ļ�ѧ����ʽΪ��![]() ��
��
��ȡһЩ��Ʒ��û�г������������м��㣬�����ʼû�г�����Ʒ��������

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ��2012��1�£������ӳ������о��������ӷ�������Ũ�ȳ����¼������ݸ��¼�ij��ѧ�С�鿪չ��һ�ι��ڽ�������ͭ�������˳���̽��������Ⱦ�¹ʴ������������ֻ��
�������ϣ����ӣ�Cd����һ������ɫ�������ڻ�������ͨ������Ϊ+2�� ��ˮ������Ԫ��ͨ�����Ȼ��ӵ���ʽ���� ���Ȼ���������ˮ����������������ˮ
��һ����������ͭ�������˳���̽��
ʵ�鲽�� | ʵ������ | ʵ����� |
ȡ�����ӡ�ͭ�������Թ��У��������� | �ӱ��������ݲ�����ͭ�������������ݲ��� | �ӵĻ��˳�����ͭ���� |
ȡ����ͭ���Թ��У�����������������Һ | �� | ͭ�Ļ��˳������� |
ʵ����ۣ����˳���ӣ�ͭ����
������������Ⱦ�¹ʴ�������������
С����Ϊ����������Ⱦ�Ӷ����������ռ����ķ�����ȥ�Ȼ��ӣ���Ӧԭ���û�ѧ����ʽ��ʾΪ ��С����Ϊ�÷�����Ȼ��Ч������ȱ�ݣ�ԭ���� ����С����С������������Ϊ������ ��д�׳ƣ������ռ
����Ŀ��ʵ������һƿ��ǩ��ȱ����ƿ��û����ȫ�ܷ����ɫ��Һ������ͼ����Ϊȷ�����е����ʣ�ͬѧ�ǽ��������µ�̽�����������뵽����ȥ���ش��й����⡣

�����в��롿�������Һ��������NaCl��
�������Һ��������NaOH��
�������Һ��������Na2CO3��
����IV������Һ��������NaHCO3.
���������ϡ����������ʵ������Ϣ���±���
���� | NaCl | NaOH | Na2CO3 | NaHCO3 |
�����µ��ܽ��/g | 36 | 109 | 21.5 | 9.6 |
������ϡ��Һ��pH | 7 | 13 | 11 | 9 |
�����ʵ������Ϣ��֪������Һ�����ʲ���NaHCO3����Ϊ������NaHCO3��Һ���ʵ��������������
����ȷ��01.%����
������ʵ�顿
��1���ⶨ��Һ��pH����7������Һ�����ʲ��� ���ѧʽ����
��2��ͬѧ���ֽ���������ʵ�飬ʵ��������£�

��������ɫ�����Ļ�ѧ����ʽ�� ��
��ʵ������ж�ԭ��ɫ��Һ�к��е������� ��
����ý��ۡ�
��ƿԭ��װ����ɫ��Һ��������NaOH������ ���û�С��������֡���ȫ���������ʡ�
����չ��
�ᴿ����ɫ��Һ�IJ����ǣ�������ɫ��Һ�м��������� ��Ȼ����ˡ���Ӧ��ѧ����ʽ�� ��
����Ŀ��ij��ѧ����Χ�ơ�����кͷ�Ӧ��,��ѧ���ֳ�����С��,����ʦ�����¿�չ̽����������ǽ�ѧƬ��,�������ѧϰ��������д�ո�(�������пո�)��
����ʾʵ�飩��һ������ϡH2SO4����ʢ��NaOH��Һ��С�ձ��С�
��ѧ�����ݣ��÷�Ӧ�Ļ�ѧ����ʽ________________��
��������⣩ʵ��δ�۲쵽��������,����ͬѧ����������:��Ӧ����Һ��������ʲô?
��������裩�������,��ҷ�������롣����ͬѧ�IJ������£�����һ:ֻ��Na2SO4�������:��____________ ��������:��Na2SO4��NaOH��������:��Na2SO4��H2SO4��NaOH������ͬѧ�����ϲ����������,��Ϊ��һ�ֲ����Dz������ġ��������IJ��뼰��������_________��
��ʵ��̽����
��1������ͬѧȡ�ձ��е���Һ�������Թ���,�μӼ���CuSO4��Һ,�����Ա仯,��Һ��һ��û��____________��
��2��Ϊ����֤�������,��ѧϰС�������ձ��е���Һ,��ѡ����ʦ�ṩ��pH��ֽ��ͭƬ��BaCl2��Һ��Na2CO3��Һ,������������������̽����
ʵ�鷽�� | ����ҺpH | �μ�Na2CO3��Һ | �μ�BaCl2��Һ |
ʵ����� |
|
|
|
ʵ������ | ��ֽ��ɫ,�Աȱ�ɫ��,pH____7(ѡ�>����<����=��) | _________ | ������ɫ���� |
ʵ����� | ��Һ����H2SO4 | ��Һ���� H2SO4 | ��Һ����H2SO4 |
���ó����ۣ�ͨ��̽��,ȫ��ͬѧһ��ȷ�����������ȷ�ġ�
�����۷�˼����ʦ��ͬѧ���ö��ַ�������̽��,���ó���ȷ���۸���϶���ͬʱָ��ʵ��̽����2���д����������Դ���,���ҷ�˼��ͬѧ�Ǿ�����˼��������������:
��1��ʵ������еĴ����� __________________ ��
��2��ʵ�鷽������һ���Ǵ����,д����˵��ʵ�鷽������ԭ��Ļ�ѧ����ʽ�� _______________��
����Ŀ��ij��ѧ��ȤС���ͬѧѧϰ�������ԭ������,���������ͼ��ʾʵ�飬���Է�Ӧ��ƿ�в�����Һ����̽����
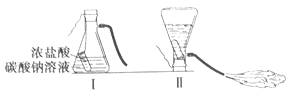
��������⣩��Һ������������ʲô?
����������裩
����1:��Һ�е�������NaCl��Na2CO3��HCl
����2:��Һ�е�����ֻ��NaCl
����3:��Һ�е�������NaCl��HCl
����4:��Һ�е�������______��
�������뽻����
С����Ϊ����I������֤��֪���Ǵ���ģ�����������_____(���û�ѧ����ʽ˵��)��
��ʵ������ۣ�
(1)С��ͬѧΪ��֤����3��ȡ������Һװ���Թ��У�Ȼ������̪��Һ��������Һ����ɫ������С����Ϊ����3��ȷ������Ϊ���Ľ���____(������ȷ������������),������______________��
���������ʵ�鷽����֤����3:
ʵ�鲽�� | ʵ������ | ʵ����� |
__________________ | __________________ | ����3��ȷ |
(2)��֤����4����ѡ����Լ���____________��
A.��̪��ҺB.����������ҺC.ϡ����D.�Ȼ�����Һ
����չ��Ӧ�ã�����Һ�е�������NaCl��HCl��������������ʣ����������Լ���ֻҪ�Է�Һ����____���������ɴӷ�Һ�еõ�NaCl���塣