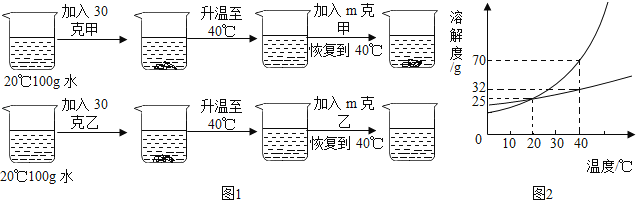
题目内容
【题目】实验室用铜辉矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质,SiO2不与酸反应)制备碱式碳酸铜(Cu2(OH)2CO3)的主要实验流程如图。
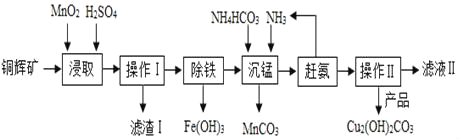
(1)Cu2S中铜元素的化合价_____。
(2)“浸取”步骤中发生反应(I、II),其中反应I为:2MnO2+Cu2S+□H2SO4=2MnSO4+2CuSO4+S↓+4H2O,请在□中填上合适的化学计量数为_____。
(3)“浸取”步骤中,另一反应II为_____。
(4)滤渣I的成分为MnO2、S、_____。
(5)赶走氨的实验操作方法是_____。
【答案】+1价 4 Fe2O3+3H2SO4═Fe2(SO4)3+3H2O SiO2 加热
【解析】
(1)根据化合物中正负化合价的代数和为零以及Cu2S中硫元素为﹣2价可得铜元素的化合价+1价。
(2)“浸取”步骤中发生反应(I、II),其中反应I为:2MnO2+Cu2S+□H2SO4=2MnSO4+2CuSO4+S↓+4H2O,根据氢原子个数不变可得硫酸的化学计量数为 4。
(3)铜辉矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质,SiO2不与酸反应),所以“浸取”步骤中,由于另一反应II为氧化铁和硫酸反应生成硫酸铁和水,对应的化学方程式为 Fe2O3+3H2SO4═Fe2(SO4)3+3H2O。
(4)铜辉矿,主要成分为Cu2S,含少量Fe2O3、SiO2等杂质,由于SiO2不与酸反应,所以滤渣I的成分为MnO2、S、SiO2。
(5)由于氨气溶解度随温度升高而降低,所以赶走氨的实验操作方法是 加热。
故答案为:
(1)+1价(2)4(3)Fe2O3+3H2SO4═Fe2(SO4)3+3H2O(4)SiO2(5)加热

【题目】云通过探究发现,氯酸钾与氧化铜(CuO)、氧化铁(Fe2O3)混合加热,也能较快产生氧气,于是进行如下探究:
(查阅资料)氯酸钾的熔点为356℃,常温下稳定,在400℃以上则分解产生氧气。酒精灯加热温度为400℃~500℃。
(提出猜想)除MnO2、CuO外,Fe2O3也可以作氯酸钾分解的催化剂。
(完成实验)按下表进行实验并测定分解温度。
实验编号 | 实验药品 | 分解温度 |
1 | 3.0g氯酸钾 | 460℃ |
2 | 3.0g氯酸钾和0.5g二氧化锰 | 248℃ |
3 | 3.0g氯酸钾和0.5g氧化铜 | 267℃ |
4 | 3.0g氯酸钾和Xg氧化铁 | 290℃ |
(分析数据,得出结论)
(1)实验3的化学反应式:______________________。
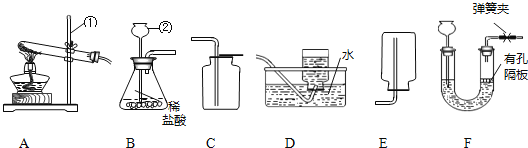
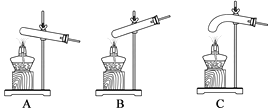
(2)小云从下图中选择该实验的最佳发生装置是__________。
(3)实验4中X的值应为__________,由实验__________与实验4对比,证明猜想合理。
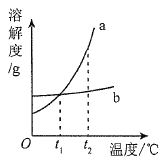
(4)通过实验测得的数据,小云绘出了部分下图,请帮他完成该图。
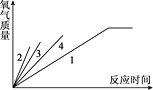
(结论)通过该实验探究中,得到的结论有__________(填序号)。
A.催化剂可降低反应温度
B.二氧化锰只能催化氯酸钾的分解
C.催化剂的质量和性质在反应前后不变
D.催化剂可改变产物的质量
E.三种催化剂中,二氧化锰对氯酸钾分解催化效果最好