题目内容
【题目】某中学开展化学实验考查,考查内容由学生抽签决定,小明同学抽签后来到实验室,实验台上为他准备的药品有:过氧化氢溶液、稀盐酸、稀硫酸、高锰酸钾固体、氯酸钾固体、二氧化锰粉末、大理石颗粒,实验台上还准备了下列仪器:
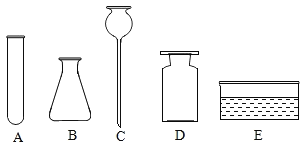
(1)写出下列仪器的名称:B______________。
(2)利用题中药品和 A-I 中仪器可以制取较多量的二氧化碳,要组装发生装置和收集装置,小明选择的仪器是______________(填序号),反应的化学方程式为___________。
(3)利用上述仪器和药品可以制取氧气,小明选择的药品是__________(写名称),若用如图 1 装置装满水,用于收集氧气,进气口应为_________________端(选填“a”或“b”)。
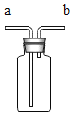
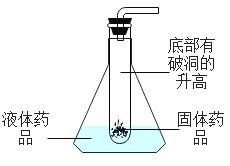
图1 图2
(4)图2是利用报废试管设计的制二氧化碳的发生装置,该设计除了废物利用的优点外,请另写一个优点 _______________________。
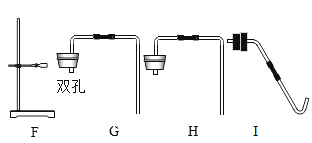
(5)过氧化钠(Na2O2)常温下能与二氧化碳发生反应。将二氧化碳发生装置与图 3 装置(气密性良好)连接,过一段时间后,图3中G 烧杯的澄清石灰水变浑浊,a 处带火星的小木条复燃。
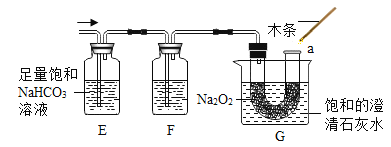
图3
①E 装置的作用是除去二氧化碳中_____________,F 装置里的试剂是___________________。
②G 中饱和的澄清石灰水变浑浊,说明过氧化钠与二氧化碳反应______________热(填“放” 或“吸”)。
③结合实验和所学知识得出 CO2 与 Na2O2 反应的生成物为__________(填字母)。
a Na2O 和 O2 b Na2CO3 和 H2 c NaOH 和 O2 d Na2CO3 和 O2
【答案】锥形瓶 BCDFG CaCO3+2HCl=CaCl2+H2O+CO2↑ 过氧化氢溶液和二氧化锰粉末 b 能控制反应的发生与停止 氯化氢气体 浓硫酸 放热 d
【解析】
(1)据图可知仪器B的名称是锥形瓶;
(2)实验室用大理石或石灰石和稀盐酸反应生成氯化钙、二氧化碳和水制取二氧化碳,不需要加热,二氧化碳能溶于水,密度比空气大,只能用向上排空气法收集;所以利用题中药品和 A-I 中仪器可以制取较多量的二氧化碳,要组装发生装置和收集装置,应选择的仪器是BCDFG,反应的化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑;
(3)仪器中没有酒精灯,可以用过氧化氢溶液和二氧化锰粉末在常温下制取氧气;氧气密度比水小,用图1收集氧气,进气口应为端b;
(4)图2是通过提升试管可以实现固体和液体的分离,所以另一个优点是:能控制反应的发生与停止;
(5)①碳酸氢钠能和氯化氢反应生成二氧化碳,所以E 装置的作用是除去二氧化碳中氯化氢气体;由于浓硫酸具有吸水性,所以装置F的作用是除去二氧化碳中的水蒸气;
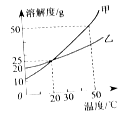
②由于反应放热,氢氧化钙的溶解度随温度的升高而减小,所以G烧杯中澄清石灰水变浑浊的原因是:反应放热,使溶液温度升高,氢氧化钙的溶解度变小,使固体从溶液中析出,溶液变浑浊;
③由题意可知,二氧化碳和过氧化钠反应生成氧气,由质量守恒定律可知,另一种物质应是碳酸钠。

【题目】下列方法不能达到除杂目的的是( )
选项 | 物质(括号内为杂质) | 方法 |
A | N2(O2) | 将混合气体通过灼热铜网 |
B | Fe粉(Cu粉) | 加入足量稀H2SO4充分反应,过滤,洗涤,干燥 |
C | CaO(CaCO3) | 高温煅烧 |
D | FeCl2溶液(CuCl2) | 加入足量Fe粉,充分反应后过滤 |
A.AB.BC.CD.D
【题目】某化学兴趣小组的同学,通过咨询老师准备用亚硫酸钠溶液与浓硫酸反应来制备一定量的SO2(Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H 2O),老师给他们提供了一瓶久置的亚硫酸钠溶液,兴趣小组的同学分成甲、乙两小组对该瓶亚硫酸钠溶液成分进行实验探究。
(查阅资料)
① Na2SO3不稳定,在空气中易被氧气氧化成Na2SO4;
②SO32-、SO42-均能与Ba2+反应产生白色沉淀;
③BaSO3 等亚硫酸盐能与稀盐酸反应,其反应原理与 BaCO3等碳酸盐与稀盐酸反应类似。
(1)(提出问题)①该瓶溶液中溶质的成分是什么?
②该瓶溶液中亚硫酸钠的质量分数是多少?
(分析问题) Na2SO3变质的原因是:_______________________。(用化学方程式表示)
(2) (作出猜想)
猜想1:没有变质,成分是Na2SO3;
猜想 2:完全变质,成分是Na2SO4;
猜想3:_____________。
(实验探究Ⅰ)甲、乙两组分别进行实验探究溶液是否变质:
小组 | 实验操作 | 现象 | 结论 |
甲组 | 取少量样品于试管中加入过量稀盐酸; | 产生气泡 | 没有变质,还是Na2SO3 |
乙组 | 取少量样品于试管中加入氯化钡溶液,再加入足量稀盐酸。 | 产生白色沉淀后 ________ | 已部分变质 |
甲组同学实验中发生的化学方程式为:________________________。有同学质疑甲组方案不合理,理由是_________________。
(3) (实验探究Ⅱ)甲组设计如下实验装置测定Na2SO3溶液的溶质质量分数。(已![]() )
)

①要测定Na2SO3溶液的溶质质量分数,实验中需要测得的数据是亚硫酸钠溶液样品的质量以及_______质量。
②D装置的作用为______________________________。