题目内容
【题目】“三效催化转换器”可将汽车尾气中有毒气体处理为无毒气体,下图为该反应的微观示意图,其中不同的球代表不同种原子,依次是氧原子、氮原子、碳原子。根据图示回答下列问题。
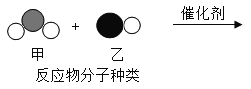
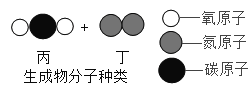
(1)该化学反应_____化合反应(填“属于”或“不属于”);
(2)写出该反应的化学方程式:_____;
(3)甲、乙、丙、丁四种物质中属于单质的是_____(写化学式);
(4)该反应中甲乙的分子个数比为_____;
(5)上述反应中,不发生改变的粒子是_____![]() 填“分子”或“原子”
填“分子”或“原子”![]() 。
。
【答案】不属于 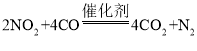 N2 1:2 原子
N2 1:2 原子
【解析】
(1)该反应生成物有两种,不符合“多变一”的特点,不属于化合反应,故填:不属于;
(2)由图可知,该反应的化学方程式为: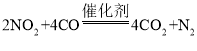 ;
;
(3)丁是由同种元素(氮元素)组成的纯净物,属于单质,故填:N2;
(4)由化学方程式可知,该反应中甲乙的分子个数比为:2:4=1:2;
(5)由图可知,反应物中为二氧化氮分子、一氧化碳分子,生成物中为二氧化碳分子,氮分子,分子种类发生了改变,该反应为化学反应,遵循质量守恒定律,根据质量守恒定律,化学反应前后,原子的种类和数目不变,故填:原子。

【题目】小明拿起家中的水壶准备煮水时,发现壶内有些褐色的固体。为了探究其成分,与兴趣小组同学查阅资料后获知这些褐色的固体是水垢,它可能是因为水中含有Ca(HCO3)2和Mg(HCO3)2等可溶性物质在加热时生成CaCO3和Mg(OH)2。
(1)含有较多Ca(HCO3)2的水称_____,加热时发生反应的化学方程式为_____。
(2)小明认为该水垢的成分只有CaCO3;但小白不同意,认为也可能只有Mg(OH)2,还可能是_____。
(3)小明为了证明自己的猜想,设计如下实验方案:
实验操作 | 现 象 | 结 论 |
①取少量水垢于试管中,加入过量的_____。 | 观察到现象_____。 | 水垢中有CaCO3 |
②向①反应后的试管中滴加2-3滴NaOH溶液 | 观察到现象_____。 | 水垢中没有Mg(OH)2,我的猜想成立 |
(3)小白不认可小明的结论,认为他的实验操作有缺陷,原因是_____。
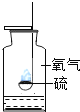
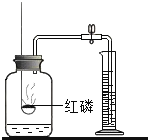
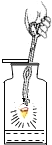
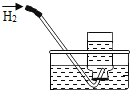
【题目】对下列实验指定容器中的水,其解释没有体现水的主要作用的是![]()
![]()
A | B | C | D | |
实 验 装 置 |
硫在氧气中燃烧 |
测定空气中氧气含量 |
铁丝在氧气中燃烧 |
排水法收集氢气 |
解释 | 集气瓶中的水: 吸收有害气体 | 量筒中的水: 通过水体积的变化得出 | 集气瓶中的水: 吸收溅落融熔物 | 集气瓶中的水: 水先将集气瓶内的空气排净,后便于观察 |
A. A B. B C. C D. D
【题目】某化学兴趣小组的同学,通过咨询老师准备用亚硫酸钠溶液与浓硫酸反应来制备一定量的SO2(Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H 2O),老师给他们提供了一瓶久置的亚硫酸钠溶液,兴趣小组的同学分成甲、乙两小组对该瓶亚硫酸钠溶液成分进行实验探究。
(查阅资料)
① Na2SO3不稳定,在空气中易被氧气氧化成Na2SO4;
②SO32-、SO42-均能与Ba2+反应产生白色沉淀;
③BaSO3 等亚硫酸盐能与稀盐酸反应,其反应原理与 BaCO3等碳酸盐与稀盐酸反应类似。
(1)(提出问题)①该瓶溶液中溶质的成分是什么?
②该瓶溶液中亚硫酸钠的质量分数是多少?
(分析问题) Na2SO3变质的原因是:_______________________。(用化学方程式表示)
(2) (作出猜想)
猜想1:没有变质,成分是Na2SO3;
猜想 2:完全变质,成分是Na2SO4;
猜想3:_____________。
(实验探究Ⅰ)甲、乙两组分别进行实验探究溶液是否变质:
小组 | 实验操作 | 现象 | 结论 |
甲组 | 取少量样品于试管中加入过量稀盐酸; | 产生气泡 | 没有变质,还是Na2SO3 |
乙组 | 取少量样品于试管中加入氯化钡溶液,再加入足量稀盐酸。 | 产生白色沉淀后 ________ | 已部分变质 |
甲组同学实验中发生的化学方程式为:________________________。有同学质疑甲组方案不合理,理由是_________________。
(3) (实验探究Ⅱ)甲组设计如下实验装置测定Na2SO3溶液的溶质质量分数。(已![]() )
)

①要测定Na2SO3溶液的溶质质量分数,实验中需要测得的数据是亚硫酸钠溶液样品的质量以及_______质量。
②D装置的作用为______________________________。