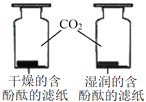
题目内容
【题目】复分解反应是我们学过的化学基本反应类型之一。
(1) 写出下列反应的化学方程式。
①氯化钡溶液与硫酸钠溶液混合:_________________________________________;
②碳酸钠溶液与稀盐酸混合:_________________________;
③氢氧化钡溶液与稀硝酸混合:______________________________。
(2)你想过上述复分解反应为什么能够发生吗?这是因为在这些反应物中含有一些“特殊”的阴、阳离子,它们能相互结合。如上述反应①中,实际参加反应的离子Ba2+和SO42-,而Cl-、Na+是“旁观者”,并没有参加反应。请你分析上述反应②中实际参加反应的离子是__________________;上述反应③中实际参加反应的离子是______________________________________________。
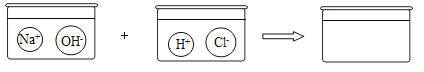
(3)请根据你的想象,在图中右边的容器中画出体现NaOH溶液和稀盐酸反应产物的示意图___________。
【答案】![]()
![]()
![]() H+、CO32- H+、OH-
H+、CO32- H+、OH- 
【解析】
(1)①氯化钡与硫酸钠反应生成硫酸钡与氯化钠,该反应的化学方程式为:![]() ;
;
②碳酸钠与稀盐酸反应生成氯化钠、二氧化碳和水,该反应的化学方程式为:![]() ;
;
③氢氧化钡与稀硝酸反应生成硝酸钡和水,该反应的化学方程式为:![]() ;
;
(2)由题意可知,能够结合生成水、气体和沉淀的离子为实际参与反应的离子,②中氢离子和碳酸根离子结合生成二氧化碳和水,故实际参与反应的离子为:H+、CO32-,③中氢离子与氢氧根离子结合生成水,故实际参与反应的离子为:H+、OH-;
(3)氢氧化钠与稀盐酸反应,实际是氢离子与氢氧根离子结合生成水,钠离子和氯离子不变,故填: 。
。

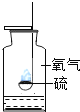
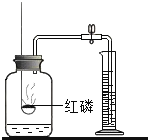
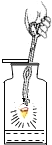
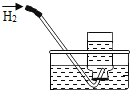
【题目】对下列实验指定容器中的水,其解释没有体现水的主要作用的是![]()
![]()
A | B | C | D | |
实 验 装 置 |
硫在氧气中燃烧 |
测定空气中氧气含量 |
铁丝在氧气中燃烧 |
排水法收集氢气 |
解释 | 集气瓶中的水: 吸收有害气体 | 量筒中的水: 通过水体积的变化得出 | 集气瓶中的水: 吸收溅落融熔物 | 集气瓶中的水: 水先将集气瓶内的空气排净,后便于观察 |
A. A B. B C. C D. D
【题目】对比实验是实验探究的重要方法,下列对比实验设计能实现相应实验目的的是
选项 | 实验目的 | 实验设计 | 选项 | 实验目的 | 实验设计 |
A | 探究温度对分子运动快慢的影响 |
| B | 探究水对铁钉锈蚀的影响 |
|
C | 探究空气是燃烧的必要条件 |
| D | 探究CO2与水反生反应 |
|
A. A B. B C. C D. D
【题目】某化学兴趣小组的同学,通过咨询老师准备用亚硫酸钠溶液与浓硫酸反应来制备一定量的SO2(Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H 2O),老师给他们提供了一瓶久置的亚硫酸钠溶液,兴趣小组的同学分成甲、乙两小组对该瓶亚硫酸钠溶液成分进行实验探究。
(查阅资料)
① Na2SO3不稳定,在空气中易被氧气氧化成Na2SO4;
②SO32-、SO42-均能与Ba2+反应产生白色沉淀;
③BaSO3 等亚硫酸盐能与稀盐酸反应,其反应原理与 BaCO3等碳酸盐与稀盐酸反应类似。
(1)(提出问题)①该瓶溶液中溶质的成分是什么?
②该瓶溶液中亚硫酸钠的质量分数是多少?
(分析问题) Na2SO3变质的原因是:_______________________。(用化学方程式表示)
(2) (作出猜想)
猜想1:没有变质,成分是Na2SO3;
猜想 2:完全变质,成分是Na2SO4;
猜想3:_____________。
(实验探究Ⅰ)甲、乙两组分别进行实验探究溶液是否变质:
小组 | 实验操作 | 现象 | 结论 |
甲组 | 取少量样品于试管中加入过量稀盐酸; | 产生气泡 | 没有变质,还是Na2SO3 |
乙组 | 取少量样品于试管中加入氯化钡溶液,再加入足量稀盐酸。 | 产生白色沉淀后 ________ | 已部分变质 |
甲组同学实验中发生的化学方程式为:________________________。有同学质疑甲组方案不合理,理由是_________________。
(3) (实验探究Ⅱ)甲组设计如下实验装置测定Na2SO3溶液的溶质质量分数。(已![]() )
)

①要测定Na2SO3溶液的溶质质量分数,实验中需要测得的数据是亚硫酸钠溶液样品的质量以及_______质量。
②D装置的作用为______________________________。