题目内容
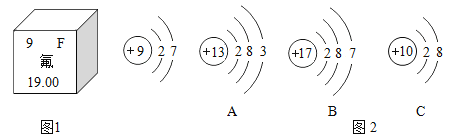
【题目】钢铁的冶炼是人类文明的一个重要标志。下图1是实验室模拟炼铁的装置图。
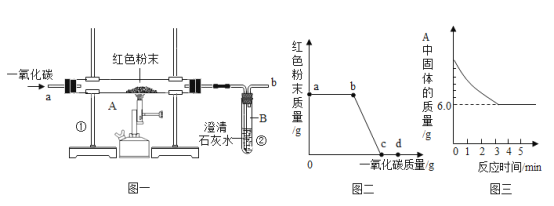
(1)写出图一中②处发生的化学反应方程式:___________________________________;
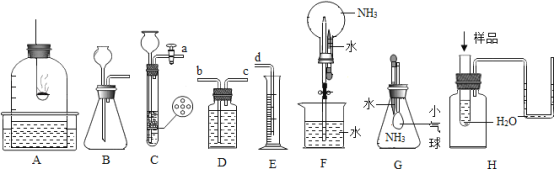
(2)实验过程中通入CO质量与红色粉末质量的关系如图2所示。根据图示,下列说法不正确的是_______(填序号)
①a 点表示开始通入CO,反应开始发生;
②b 点表示通入CO一段时间后加热,反应开始发生;
③c 点表示红色粉末已充分参加反应;
④d 点表示反应结束后仍需继续通入CO;
⑤可根据通入CO的质量计算出红色粉末的质量。
(3)图一装置中的不足之处是__________________________________;
(4)该实验炼制的铁与工业炼制出的铁最大的区别是________________________。
(5)某化学小组的同学们利用上述实验对一份固体样品进行了探究。通过实验已确定该样品由氧化铁和铁粉混合而成。他们取了固体样品质量7.2 g,用图1所示的装置重新实验,测定的部分数据如图3所示,则原样品中铁元素与氧元素的质量比是__________。
【答案】![]() ①⑤。 无尾气处理装置 该装置炼制的铁是纯净物,工业炼制的生铁是混合物 5:1
①⑤。 无尾气处理装置 该装置炼制的铁是纯净物,工业炼制的生铁是混合物 5:1
【解析】
图一中一氧化碳和氧化铁在高温条件下反应生成二氧化碳和铁,二氧化碳使澄清的石灰水变浑浊。图2一开始通入一氧化碳时,氧化铁质量不变,是因为装置中有空气,先用一氧化碳将空气排净,再点燃酒精喷灯,这时一氧化碳与氧化铁反应,反应结束后,为了防止倒吸,需继续通一氧化碳直至冷却至室温。
(1)图一中②处澄清的石灰水变浑浊,是二氧化碳和氢氧化钙反应生成了碳酸钙沉淀和水,化学方程式为![]() ;
;
(2)图二中a点反应并未开始,而是用一氧化碳将装置中的空气排净,b点一氧化碳与氧化铁开始反应,红色粉末质量减小,到c点反应结束,红色粉末质量不再变化,为了防止倒吸,需继续通一氧化碳直至冷却至室温。因为通入的一氧化碳不是都和氧化铁反应了,所以不能根据通入一氧化碳的质量计算出氧化铁的质量,故错误的是①⑤;
(3)一氧化碳有毒,不能直接排放到空气中,图1装置中的不足之处是无尾气处理装置;
(4)该实验炼制的铁与工业炼制出的铁最大的区别是该装置炼制的铁是纯净物,工业炼制的生铁是混合物;
(5)因为样品由氧化铁和铁粉混合而成,所以样品中只有两种元素:铁元素和氧元素,总质量为7.2g。反应完全后固体中只剩铁元素,根据质量守恒定律,反应前后铁元素的质量不变,所以样品中铁元素的质量就是6.0g,减少的质量是氧元素的质量1.2g,故样品中铁元素与氧元素的质量比=6.0:1.2=5:1。

 百年学典课时学练测系列答案
百年学典课时学练测系列答案【题目】下列方法不能达到除杂目的的是( )
选项 | 物质(括号内为杂质) | 方法 |
A | N2(O2) | 将混合气体通过灼热铜网 |
B | Fe粉(Cu粉) | 加入足量稀H2SO4充分反应,过滤,洗涤,干燥 |
C | CaO(CaCO3) | 高温煅烧 |
D | FeCl2溶液(CuCl2) | 加入足量Fe粉,充分反应后过滤 |
A.AB.BC.CD.D
【题目】某化学兴趣小组的同学,通过咨询老师准备用亚硫酸钠溶液与浓硫酸反应来制备一定量的SO2(Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H 2O),老师给他们提供了一瓶久置的亚硫酸钠溶液,兴趣小组的同学分成甲、乙两小组对该瓶亚硫酸钠溶液成分进行实验探究。
(查阅资料)
① Na2SO3不稳定,在空气中易被氧气氧化成Na2SO4;
②SO32-、SO42-均能与Ba2+反应产生白色沉淀;
③BaSO3 等亚硫酸盐能与稀盐酸反应,其反应原理与 BaCO3等碳酸盐与稀盐酸反应类似。
(1)(提出问题)①该瓶溶液中溶质的成分是什么?
②该瓶溶液中亚硫酸钠的质量分数是多少?
(分析问题) Na2SO3变质的原因是:_______________________。(用化学方程式表示)
(2) (作出猜想)
猜想1:没有变质,成分是Na2SO3;
猜想 2:完全变质,成分是Na2SO4;
猜想3:_____________。
(实验探究Ⅰ)甲、乙两组分别进行实验探究溶液是否变质:
小组 | 实验操作 | 现象 | 结论 |
甲组 | 取少量样品于试管中加入过量稀盐酸; | 产生气泡 | 没有变质,还是Na2SO3 |
乙组 | 取少量样品于试管中加入氯化钡溶液,再加入足量稀盐酸。 | 产生白色沉淀后 ________ | 已部分变质 |
甲组同学实验中发生的化学方程式为:________________________。有同学质疑甲组方案不合理,理由是_________________。
(3) (实验探究Ⅱ)甲组设计如下实验装置测定Na2SO3溶液的溶质质量分数。(已![]() )
)

①要测定Na2SO3溶液的溶质质量分数,实验中需要测得的数据是亚硫酸钠溶液样品的质量以及_______质量。
②D装置的作用为______________________________。