题目内容
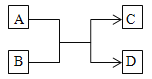
【题目】某化学反应的微观示意图如下,根据该图得出的结论正确的是()
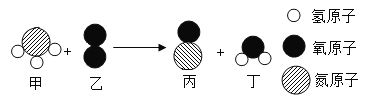
A.该反应属于置换反应
B.甲和乙的分子个数比为4∶5
C.反应前后只有氮元素的化合价发生了变化
D.化学反应前后分子种类和数目都没变
【答案】B
【解析】
由化学反应的微观示意图可知,该反应是氨气和氧气反应生成了一氧化氮和水,反应的化学方程式是: 。
。
A、由图示和化学方程式可知,该反应是一种单质和一种化合物反应,生成两种化合物,不属于置换反应,选项A错误;
B、由化学方程式可知,恰好完全反应时,甲和乙两物质的化学计量数之比为4∶5,选项B正确;
C、由化学方程式可知,反应前后氧、氮元素的化合价都发生了变化,选项C错误;
D、由化学方程式可知,化学反应前后分子种类和数目都发生变化,选项D错误。故选B。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
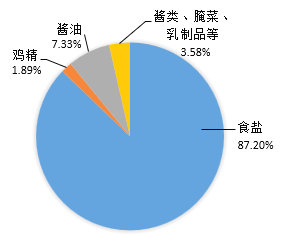
小学生10分钟应用题系列答案【题目】在人体中,钠元素有重要的生理功能:调节水量、维持酸碱平衡、维持血压等。我国居民膳食中每日通过食品或调料获得钠元素的主要来源如图所示。
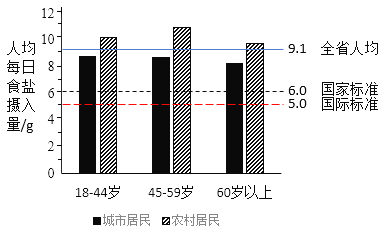
如图为2015年我国某省份人均每日食盐摄入量与国家推荐标准和世界卫生组织(WHO)推荐的国际标准的比对。
事实证明,中国人的膳食结构中钠元素过多,钾元素过少,这样的情况易导致高血压的发生。为此,以碘盐为基础,加入有咸味的氯化钾,用氯化钾代替部分氯化钠(减钠增钾),使钠、钾比例合理,形成低钠盐。低钠盐有利于防治高血压,通常属于推荐用盐。但高温作业者、重体力劳动强度的工作人员(汗液流失会带走大量钠离子)、肾脏病或高钾血症患者不建议选用。北京超市中常见的深井岩盐和低钠岩盐成分配料表
种类 | NaCl (g/100 g) | KCl (g/100 g) | KIO3(以I计)(mg/kg) | K4Fe(CN)6(以[Fe(CN)6]4-计)(mg/kg) |
深井岩盐 | ≥98.5 | 0 | 18~33 | ≤10 |
低钠岩盐 | 65~80 | 20~35 | 18~33 | ≤10 |
依据文章内容回答下列问题。
(1)由图可知,人们获得钠元素的主要来源是_____。
(2)食盐中K4Fe(CN)6的主要作用是抗结剂,K4Fe(CN)6是由_____种元素组成的。
(3)由图可知,下列说法不正确的是_____(填字母序号)。
A 该省份人均每日摄入食盐的量超过了国家推荐的标准
B 我国对食盐摄入量的推荐标准高于世界卫生组织(WHO)推荐的国际标准
C 无论是城市居民还是农村居民,都是年龄越大,人均每日摄入食盐越少
D 在图示的每个年龄段中,农村居民的人均每日食盐摄入量都比城市居民多
(4)低钠盐既保证了调味需求,还有利于防治高血压,原因是_____。
(5)依据表格,你建议外卖小哥在炎热的夏天选用的盐是_____。
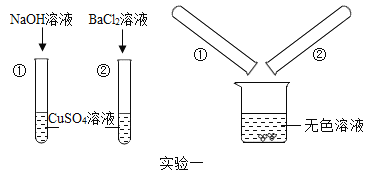
【题目】某化学兴趣小组的同学为了探究“复分解反应发生的条件”,做了如图两个实验:
实验二
组合序号 | ③ | ④ | ⑤ |
组合的溶液 | H2SO4 NaOH | H2SO4 NaCl | H2SO4 Na2CO3 |
(实验一):
把试管①②中静置后的上层清液倒入洁净的烧杯中,最后只得到蓝色沉淀和无色溶液。
(1)写出混合后得到蓝色沉淀一定发生反应的化学方程式 _________。
(2)混合后所得无色溶液中一定含有的溶质是_______(填化学式,下同)可能含有的溶质是_________。请你设计实验证明混合后所得的无色溶液中可能含有的物质存在:
实验操作 | 实验现象 | 实验结论 |
取反应后的溶液少量于试管 中,向其中加入________ | ________ | 可能含有的物质存在 |
(实验二):
(3)在组合③、④、⑤中,组合_____无明显现象,但它们的实质不同,为了证明实质不同,小夕在实验过程中使用了酚酞试液。
(4)实验结束后把3个组合反应后的溶液混合,混合后溶液也显无色。混合后所得溶液中除酚酞外,溶质的组成可能是_______(填化学式)。
(结论):
(5)复分解反应发生的条件是:生成物中有__________。
【题目】研究金属的腐蚀对资源的利用和保护意义重大。
(1)为了探究铁锈蚀的条件,进行如图-12所示实验。经过一周后观察,试管A和C中的铁钉无明显变化,试管B中的铁钉明显锈蚀。
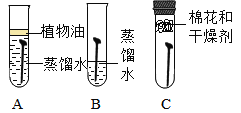
①通过实验发现:铁锈蚀是铁与_____________发生化学反应的过程。
② A中加入的蒸馏水要事先煮沸,其目的是______________________。
(2)家中的刀具若沾有食盐水锈蚀更快。为了进一步探究影响铁锈蚀速率的因素,做了如下的实验。
(提出问题)铁锈蚀速率与哪些因素有关。
(查阅资料)①物质溶解在水中得到的混合物称为水溶液,如氯化钠溶解在水中得到氯化钠溶液,乙醇溶解在水中得到乙醇溶液。
②氯化钠溶液能导电;乙醇溶液不能导电。
(猜想)铁的锈蚀速率与下列因素有关:
①反应时的温度;②氧气的含量;③水溶液的导电性。
(实验)每次取两套如图-13所示的装置,编号为I、II。向两套装置中分别装入质量、大小相同的铁钉和等体积的蒸馏水,进行如下三组对比实验(实验开始时,各瓶内气体压强保持一致)。
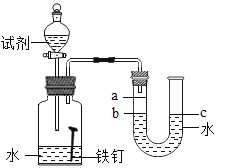
影响因素 | 实验设计 | 实验现象 | 实验结论及解释 |
①温度 | 装置I放入25℃恒温环境中,装置II放入40℃恒温环境中。 | 两套装置中铁钉均锈蚀,且U型管中液面均由b处上升至a处,则所需时间I>II。 | 锈蚀的速率I<II;铁的锈蚀速率与反应时的温度有关,_。 |
②氧气含量 |
|
| 铁的锈蚀速率与氧气的含量有关,氧气的含量越多,铁的锈蚀越快。 |
③水溶液的导电性 | 在相同温度下,装置I集气瓶中加入10mL氯化钠溶液;装置II集气瓶中加入10mL乙醇。 | 两套装置中铁钉均锈蚀; |
|
(3)若将两根铁钉分别放入两支试管中,在一支试管中加入稀硫酸,另一支试管中加入稀盐酸,观察到两支试管内均有大量气泡产生,铁钉逐渐溶解,在酸溶液中被快速腐蚀。
(反思与提高)
根据该探究实验以及你所学的知识,判断下列说法正确的是________(填序号)。
A金属的腐蚀是指金属单质与其它物质发生化学反应的过程[
B金属越活泼,就越容易被锈蚀
C金属腐蚀不一定要有氧气参加