题目内容
【题目】研究金属的腐蚀对资源的利用和保护意义重大。
(1)为了探究铁锈蚀的条件,进行如图-12所示实验。经过一周后观察,试管A和C中的铁钉无明显变化,试管B中的铁钉明显锈蚀。

①通过实验发现:铁锈蚀是铁与_____________发生化学反应的过程。
② A中加入的蒸馏水要事先煮沸,其目的是______________________。
(2)家中的刀具若沾有食盐水锈蚀更快。为了进一步探究影响铁锈蚀速率的因素,做了如下的实验。
(提出问题)铁锈蚀速率与哪些因素有关。
(查阅资料)①物质溶解在水中得到的混合物称为水溶液,如氯化钠溶解在水中得到氯化钠溶液,乙醇溶解在水中得到乙醇溶液。
②氯化钠溶液能导电;乙醇溶液不能导电。
(猜想)铁的锈蚀速率与下列因素有关:
①反应时的温度;②氧气的含量;③水溶液的导电性。
(实验)每次取两套如图-13所示的装置,编号为I、II。向两套装置中分别装入质量、大小相同的铁钉和等体积的蒸馏水,进行如下三组对比实验(实验开始时,各瓶内气体压强保持一致)。

影响因素 | 实验设计 | 实验现象 | 实验结论及解释 |
①温度 | 装置I放入25℃恒温环境中,装置II放入40℃恒温环境中。 | 两套装置中铁钉均锈蚀,且U型管中液面均由b处上升至a处,则所需时间I>II。 | 锈蚀的速率I<II;铁的锈蚀速率与反应时的温度有关,_。 |
②氧气含量 |
|
| 铁的锈蚀速率与氧气的含量有关,氧气的含量越多,铁的锈蚀越快。 |
③水溶液的导电性 | 在相同温度下,装置I集气瓶中加入10mL氯化钠溶液;装置II集气瓶中加入10mL乙醇。 | 两套装置中铁钉均锈蚀; |
|
(3)若将两根铁钉分别放入两支试管中,在一支试管中加入稀硫酸,另一支试管中加入稀盐酸,观察到两支试管内均有大量气泡产生,铁钉逐渐溶解,在酸溶液中被快速腐蚀。
(反思与提高)
根据该探究实验以及你所学的知识,判断下列说法正确的是________(填序号)。
A金属的腐蚀是指金属单质与其它物质发生化学反应的过程[
B金属越活泼,就越容易被锈蚀
C金属腐蚀不一定要有氧气参加
【答案】氧气和水 把溶解在水中的氧气排出 温度越高,铁的锈蚀速率越快 在相同温度下,向I、II两套装置的集气瓶中分别通入氧气和空气 铁钉均锈蚀,且U型管中液面由b处上升至a处所需时间I< II 铁的锈蚀速率与水溶液的导电性有关,在能导电的溶液中,锈蚀的速率加快 AC
【解析】
(1)①B中的铁钉与氧气和水充分接触,生锈了,说明铁与氧气和水同时接触时容易生锈。
②蒸馏水中溶解有少量的氧气,加热煮沸的目的是把溶解在水中的氧气排出。
(2)根据两套装置中铁钉均锈蚀所需时间I>II,可得出结论温度越高,铁的锈蚀速率越快由结论知,铁的锈蚀速率与氧气的含量有关,氧气的含量越多,铁的锈蚀越快.可设计实验步骤为:在相同温度下,向I、II两套装置的集气瓶中分别通入氧气和空气,由此得到现象为:铁钉均锈蚀,且U型管中液面由b处上升至a处所需时间I<II,根据实验现象:两套装置中铁钉均锈蚀,且U型管中液面均由b处上升至a处,则所需时间I<II.则得出的结论为:铁的锈蚀速率与水溶液的导电性有关,在能导电的溶液中,锈蚀的速率加快。
影响因素 | 实验设计 | 实验现象 | 实验结论及解释 |
①温度 | 装置I放入25℃恒温环境中,装置II放入40℃恒温环境中。 | 两套装置中铁钉均锈蚀,且U型管中液面均由b处上升至a处,则所需时间I>II。 | 锈蚀的速率I<II;铁的锈蚀速率与反应时的温度有关,温度越高,铁的锈蚀速率越快。 |
②氧气含量 | 在相同温度下,向I、II两套装置的集气瓶中分别通入氧气和空气。 | 铁钉均锈蚀,且U型管中液面由b处上升至a处所需时间I< II。 | 铁的锈蚀速率与氧气的含量有关,氧气的含量越多,铁的锈蚀越快。 |
③水溶液的导电性 | 在相同温度下,装置I集气瓶中加入10mL氯化钠溶液;装置II集气瓶中加入10mL乙醇。 | 两套装置中铁钉均锈蚀; | 铁的锈蚀速率与水溶液的导电性有关,在能导电的溶液中,锈蚀的速率加快。 |
(3)A、金属锈蚀就是金属与其他物质发生化学反应,故A正确;
B、金属越活泼,不一定越容易被锈蚀,如铝生成一层致密的氧化铝保护膜阻止了铝进一步被氧化,故B不正确;
C、由以上实验三可知,金属的锈蚀与水溶液的导电性有关,金属腐蚀不一定要有氧气参加,故C正确。故选AC。

【题目】下面是兴趣小组同学对暴露在空气的氢氧化钠固体的探究。请回答下列问题:
(提出问题)
该氢氧化钠固体有没有变质?
(进行实验)
甲同学取少量固体于试管中用足量的水溶解,后加入少量的氯化钙溶液,观察到__________,证明氢氧化钠固体已经含有碳酸钠。
(提出问题)
如何除去氢氧化钠固体中的杂质,得到纯净的氢氧化钠呢?
(进行实验)
乙同学对该氢氧化钠固体进行提纯,按如下操作流程进行实验:

(实验分析)
(1)步骤②的主要操作名称是__________,步骤②中的反应的化学方程式是__________。
(2)步骤②中加入稍过量的氢氧化钙目的是__________。
(3)为获得纯净的氢氧化钠,步骤③所包含的具体操作是蒸发浓缩、__________(选填“蒸发结晶”或“降温结晶”)、过滤。
(4)丙同学认为乙同学流程中的氢氧化钙微溶于水,需要使用较大量的水,提高蒸发难度,可以用_______试剂代替。
(实验拓展)
如何测定久置的烧碱样品中氢氧化钠的质量分数?
从一瓶久置的烧碱中称取20g,干燥后剩余固体固体质量为19g,完全溶于水中配成100g样品溶液,现取一定溶质的质量分数的氯化钡溶液与样品溶液混合,充分反应后得到如表所示的数据。
项目和次数 | 第1次 | 第2次 | 第3次 | 第4次 |
样品溶液质量(g) | 10 | 20 | 30 | 40 |
氯化钡溶液质量(g) | 10 | 15 | 15 | 30 |
产生沉淀的质量(g) | 1.97 | 3.94 | 3.94 | X |
表中第__________次反应恰好完全进行
(5)请计算样品中氢氧化钠的质量分数?__________(请写具体解题过程)
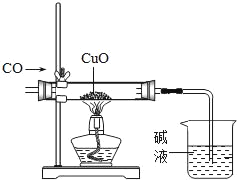
【题目】科学贵在创新,以下是对部分化学实验的改进,其中不能达到目的是( )
A | B | |
改 进 后 实 验 |
燃烧条件 |
CO还原氧化剂 |
目的 | 防止燃烧产物污染空气 | 防止尾气对大气的污染 |
C | D | |
改 进 后 实 验 |
测定氧气含量 |
检验气密性 |
目的 | 不用酒精灯点燃,使测定结果更精确 | 现象更明显 |
A. AB. BC. CD. D