题目内容
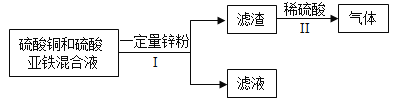
【题目】如图所示
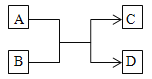
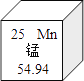
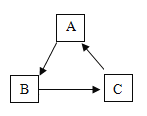
(1)若A为密度最小的气体,D为紫红色固体单质,则C的化学式为_______;B 与稀硫酸反应的化学方程式为________。
(2)已知A、C是组成元素相同的化合物,若B是红棕色粉末,D是黑色粉末,则该方应的化学方程式为________。
【答案】H2O ![]() Fe2O3+3CO
Fe2O3+3CO![]() 2Fe+3CO2
2Fe+3CO2
【解析】
(1)A为密度最小的气体,所以,A为氢气;D为紫红色固体单质,则D为铜;由此可知,该反应为氢气还原氧化铜产生铜和水的置换反应;因为氢气具有还原性,根据图推断出,B为氧化铜,C为水H2O,氧化铜与稀硫酸反应的产生硫酸铜和水的化学方程式:![]() ;
;
(2)因为已知条件是:B是红棕色粉末,D是黑色粉末。可以得出,B为氧化铁,对应的D为铁;该反应是一氧化碳在高温条件下与氧化铁反应产生铁和二氧化碳的化学方程式:Fe2O3+3CO![]() 2Fe+3CO2。
2Fe+3CO2。

【题目】下面是兴趣小组同学对暴露在空气的氢氧化钠固体的探究。请回答下列问题:
(提出问题)
该氢氧化钠固体有没有变质?
(进行实验)
甲同学取少量固体于试管中用足量的水溶解,后加入少量的氯化钙溶液,观察到__________,证明氢氧化钠固体已经含有碳酸钠。
(提出问题)
如何除去氢氧化钠固体中的杂质,得到纯净的氢氧化钠呢?
(进行实验)
乙同学对该氢氧化钠固体进行提纯,按如下操作流程进行实验:

(实验分析)
(1)步骤②的主要操作名称是__________,步骤②中的反应的化学方程式是__________。
(2)步骤②中加入稍过量的氢氧化钙目的是__________。
(3)为获得纯净的氢氧化钠,步骤③所包含的具体操作是蒸发浓缩、__________(选填“蒸发结晶”或“降温结晶”)、过滤。
(4)丙同学认为乙同学流程中的氢氧化钙微溶于水,需要使用较大量的水,提高蒸发难度,可以用_______试剂代替。
(实验拓展)
如何测定久置的烧碱样品中氢氧化钠的质量分数?
从一瓶久置的烧碱中称取20g,干燥后剩余固体固体质量为19g,完全溶于水中配成100g样品溶液,现取一定溶质的质量分数的氯化钡溶液与样品溶液混合,充分反应后得到如表所示的数据。
项目和次数 | 第1次 | 第2次 | 第3次 | 第4次 |
样品溶液质量(g) | 10 | 20 | 30 | 40 |
氯化钡溶液质量(g) | 10 | 15 | 15 | 30 |
产生沉淀的质量(g) | 1.97 | 3.94 | 3.94 | X |
表中第__________次反应恰好完全进行
(5)请计算样品中氢氧化钠的质量分数?__________(请写具体解题过程)
【题目】银白色的金属钠是化学实验室中常见的药品,其化学性质十分活泼。某化学兴趣小组的同学,进行如下探究活动。
[查阅资料]
将一小块银白色的金属钠放置在空气中会发生下列变化:
钠![]() 钠的氧化物
钠的氧化物![]() 氢氧化钠溶液
氢氧化钠溶液![]() 白色固体
白色固体
[查阅资料]
A.钠的氧化物有氧化钠(Na2O)和过氧化钠(Na2O2),都能与水反应,反应化学方程式
如:Na2O+H2O=2NaOH;2Na2O2+2H2O=4NaOH+O2↑
B.CaCl2溶液呈中性;碳酸钠溶液能与CaCl2溶液发生复分解反应;
C.碳酸钠溶液与盐酸反应方程式有:
Na2CO3 +HCl=NaHCO3 +NaCl(盐酸量不足)
Na2CO3+2HCl=2NaCl+H2O+CO2↑(盐酸量过量)
探究一:钠的氧化物是Na2O还是Na2O2 ?
(1)为检验常温下钠与氧气反应的产物,是Na2O还是Na2O2,完成实验方案:
选取试剂 | 实验现象 | 实验结论 |
__________ | __________ | 产物为Na2O |
探究二:白色固体是NaOH还是Na2CO3 ?
(2) 钠在空气中放置一段时间得到白色固体的成分
猜想1:Na2CO3 猜想2:NaOH 猜想3:Na2CO3和NaOH
[实验1] 取少量白色固体加水配成溶液,再滴入几滴稀盐酸,无气泡产生。
化学小组认为:据此现象,还不能得出猜想2成立。理由是________________。
[实验2] 化学小组进行如下实验
实验操作 | 实验现象 | 实验结论 |
①取少量白色固体配成溶液,加入足量______ | __________ | 猜想3成立 |
②过滤,取少量滤液滴入___________ | __________ |