题目内容
【题目】学习了MnO2对过氧化氢分解有催化作用的知识后.某同学想:Fe2O3能否起到类似MnO2的催化剂作用呢?于是进行了以下探究.
(猜想)I.Fe2O3是反应的催化剂,反应前后__;
II.Fe2O3参与反应产生O2,反应前后质量和化学性质发生了改变;
III.Fe2O3不是催化剂、也不参与反应,反应前后质量和化学性质不变.
(查阅资料)Fe2O3属于碱性氧化物,能够与稀盐酸反应生成氯化铁;氯化铁溶液显棕黄色.
(实验)用天平称量 0.3gFe2O3,取5mL5%的过氧化氢溶液于试管中,进行如下实验:
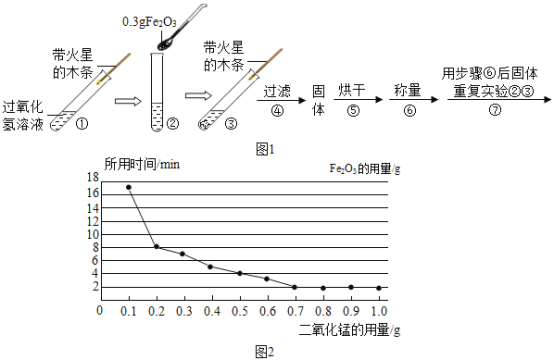
(1)填写下表:
步骤③现象 | 步骤⑥结果 | 步骤⑦现象 | 结论 |
__,带火星的木条复燃. | __ | 溶液中有气泡放出, __ | 猜想I成立; 猜想II、III不成立. |
(2)步骤①的目的是__.
(3)步骤④需用到的实验仪器有:铁架台(带铁圈)、漏斗、烧杯、__.
(4)过氧化氢能被Fe2O3催化分解放出O2的化学方程式为__.
(拓展)
(1)要探究步骤⑤做过催化剂的Fe2O3其它化学性质,还应补做的实验是__(写一种).
(2)该同学为了探究Fe2O3的用量对H2O2分解速率的影响.每次均用30mL 10%的H2O2溶液,使用不同质量的Fe2O3作催化剂,测定每次收集到500mL O2所用的时间.结果如图(其他实验条件相同),由图可知,Fe2O3的用量对H2O2分解速率影响的规律是:
①__;
②Fe2O3的用量超出一定范围后,其用量再增大,反应速率不再继续加快.
【答案】质量和化学性质都不变 有气泡放出 Fe2O3质量仍为0.3g(或固体质量仍为0.3g) 带火星木条复燃 与步骤③对比,检验加入Fe2O3前后H2O2的分解速度有无变化 玻璃棒 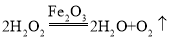 用稀盐酸(或稀硫酸)溶解固体,观察是否生成棕黄色溶液 在一定范围内,MnO2的用量越大,H2O2分解速率越快
用稀盐酸(或稀硫酸)溶解固体,观察是否生成棕黄色溶液 在一定范围内,MnO2的用量越大,H2O2分解速率越快
【解析】
[猜想]I.催化剂的特点是“一变,两不变”,即反应速率变,质量和化学性质不变;
[实验](1)氧化铁对过氧化氢的分解有催化作用,能加快其分解速率生成氧气的速率,故现象是有气泡,带火星的木条复燃;催化剂的特点是“一变,两不变”,反应前后其质量不变,所以氧化铁的质量仍为0.3g,即步骤⑥、⑦的结果中的氧化铁的质量不变;催化剂的特点是“一变,两不变”,其中反应速率改变,这里是加快,所以步骤⑦的现象是溶液中有气泡放出,带火星的木条复燃;
(2)步骤①的目的是与步骤③对比,检验加入Fe2O3前后H2O2的分解速度有无变化;故填:与步骤③对比,检验加入Fe2O3前后H2O2的分解速度有无变化;
(3)过滤操作中需要的仪器是铁架台(带铁圈)、漏斗、烧杯、玻璃棒;
(4)过氧化氢在氧化铁的催化作用下生成水和氧气;学方程式为: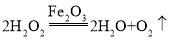 ;
;
[拓展](1)氧化铁是一种金属氧化物能与酸反应生成黄色的铁盐溶液;要探究步骤⑤做过催化剂的Fe2O3其它化学性质,还应补做的实验是用稀盐酸(或稀硫酸)溶解固体,观察是否生成棕黄色溶液;
(2)据二氧化锰的用量和收集等体积氧气所用时间的长短的图象可知:反应中二氧化锰的质量在0.1g~0.7g之间时,用量越大,过氧化氢的分解速率越快,当二氧化锰的用量超过0.7g时,反应速率速率不再随二氧化锰的用量增加而加快。由图可知,Fe2O3的用量对H2O2分解速率影响的规律是:在一定范围内,MnO2的用量越大,H2O2分解速率越快。

 阅读快车系列答案
阅读快车系列答案