题目内容
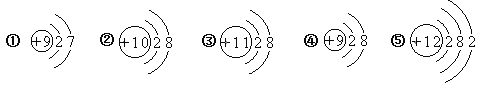
【题目】丙醇在很多情况下可代替沸点较低的乙醇用作有机溶剂,如图是丙醇的分子结构图,其化学式为C3H7OH。下列有关丙醇的说法正确的是:
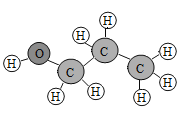
A.丙醇是由碳、氢、氧三种原子构成的
B.丙醇中碳、氢、氧的质量比为3∶8∶1
C.丙醇中氢元素的质量分数最大
D.丙醇不属于氧化物,但属于有机化合物
【答案】D
【解析】
A、丙醇是由丙醇分子构成的,A错。
B、丙醇中碳、氢、氧元素质量比为(3×12)∶(8×1)∶(1×16)=9:2:4,故B错。
C、由丙醇中碳、氢、氧元素质量比为(3×12)∶(8×1)∶(1×16)=9:2:4,可知碳元素质量分数最大,故C错。
D、丙醇中含有三种元素,不属于氧化物,但含碳元素属于有机化合物,D正确。
故选:D。

【题目】学习了MnO2对过氧化氢分解有催化作用的知识后.某同学想:Fe2O3能否起到类似MnO2的催化剂作用呢?于是进行了以下探究.
(猜想)I.Fe2O3是反应的催化剂,反应前后__;
II.Fe2O3参与反应产生O2,反应前后质量和化学性质发生了改变;
III.Fe2O3不是催化剂、也不参与反应,反应前后质量和化学性质不变.
(查阅资料)Fe2O3属于碱性氧化物,能够与稀盐酸反应生成氯化铁;氯化铁溶液显棕黄色.
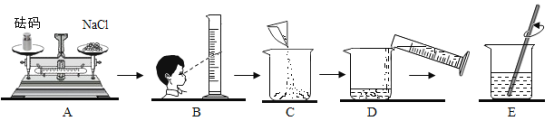
(实验)用天平称量 0.3gFe2O3,取5mL5%的过氧化氢溶液于试管中,进行如下实验:
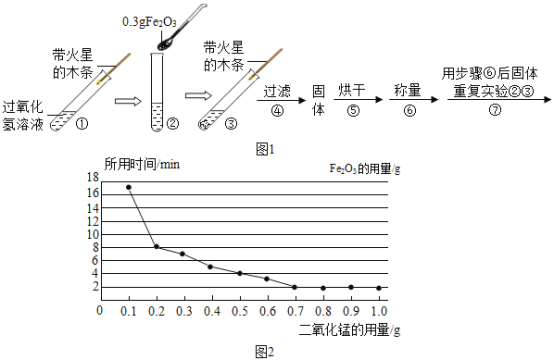
(1)填写下表:
步骤③现象 | 步骤⑥结果 | 步骤⑦现象 | 结论 |
__,带火星的木条复燃. | __ | 溶液中有气泡放出, __ | 猜想I成立; 猜想II、III不成立. |
(2)步骤①的目的是__.
(3)步骤④需用到的实验仪器有:铁架台(带铁圈)、漏斗、烧杯、__.
(4)过氧化氢能被Fe2O3催化分解放出O2的化学方程式为__.
(拓展)
(1)要探究步骤⑤做过催化剂的Fe2O3其它化学性质,还应补做的实验是__(写一种).
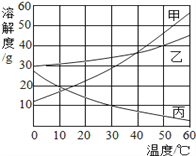
(2)该同学为了探究Fe2O3的用量对H2O2分解速率的影响.每次均用30mL 10%的H2O2溶液,使用不同质量的Fe2O3作催化剂,测定每次收集到500mL O2所用的时间.结果如图(其他实验条件相同),由图可知,Fe2O3的用量对H2O2分解速率影响的规律是:
①__;
②Fe2O3的用量超出一定范围后,其用量再增大,反应速率不再继续加快.