题目内容
【题目】天然水净化为自来水的主要流程如下:
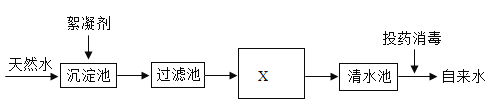
(1)过滤池的作用是除去_______________杂质。
(2)X为活性炭___________池。
(3)如果作为水源的天然水是硬水,向所得的自来水中加入少量肥皂水,振荡,观察到出现较多_________。
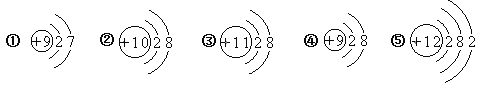
(4)目前不少自来水用液氯作为消毒剂,液氯注入水后发生反应的示意图如下:

该反应前后不变的粒子是__________(填化学符号);化合价发生改变的元素有_________种(填“1”、“2”或“3”)。
【答案】难溶性 吸附 浮渣(或沉淀) Cl、H、O 1
【解析】
(1)过滤池的作用是除去难溶性杂质。
(2)活性炭具有吸附性,X为活性炭吸附池。
(3)如果作为水源的天然水是硬水,向所得的自来水中加入少量肥皂水,振荡,观察到出现较多浮渣。
(4)观察微观示意图,可知反应的方程式为:Cl2+H2O=HCl+HClO,由微粒的变化可知,该反应前后不变的粒子氯原子、氢原子、和氧原子,符号为:Cl、H、O;由方程式可知,反应前的氯气是单质,氯元素的化合价为0;根据化合物中各元素正负化合价代数和为0,设生成的氯化氢中氯元素的化合价为x,次氯酸中氯元素的化合价是y,生成物氯化氢中氢元素为+1价,次氯酸中氢元素的化合价是+1,次氯酸中氧元素的化合价是-2,可得x+1=0;1+y+(-2)=0,得x=-1,y=+1,即氯化氢中氯元素的化合价是-1,次氯酸中氯元素的化合价是+1,因此氯元素的化合价发生了改变,氢、氧元素的化合价反应前后没有发生变化,分别为+1价和-2价,故化合价发生改变的元素有1种。

 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案【题目】研究金属的腐蚀对资源的利用和保护意义重大。
(1)为了探究铁锈蚀的条件,进行如图 1 所示实验。
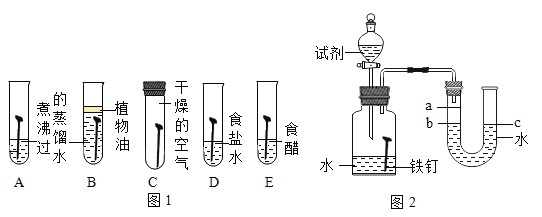
①通过观察实验 A、B、C 中的现象,经过科学严谨的推理得出结论:铁锈蚀是铁与____________发生化学反应的过程。
②实验 D 和 E 的目的是进一步探究铁在盐溶液和酸的环境中是否更容易锈蚀。铁跟醋酸(CH3COOH) 反 应生成醋酸亚铁[ (CH3COO)2Fe ]和氢气 ,请写出反应的化学方程式____________________。
(2)家中的刀具若沾有食盐水锈蚀更快。为了进一步探究影响铁锈蚀速率的因素,做了如下的实验。
(提出问题)铁锈蚀速率与哪些因素有关。
(查阅资料)氯化钠溶液能导电;乙醇溶液不能导电。
(猜想假设)铁的锈蚀速率与下列因素有关:
I._________________;
II.氧气的含量;
Ⅲ.水溶液的导电性。
(实验探究)每次取两套如图 2 所示的装置,编号为甲、乙。向两套装置中分别装入质量、大小相同的铁钉和等体积的蒸馏水,进行如下三组对比实验(实验开始时,各瓶内气体压强保持一致)。
影响 因素 | 实验设计 | 实验现象 | 实验结论及解释 |
I. | 装置甲放入 25℃恒温环境中, 装置乙放入 40℃恒温环境中。 | 两套装置中铁钉均锈蚀,且 U型管中液面均由 b 处上升至 a处,所需时间甲>乙 | ____________ |
II. | 在相同温度下,向甲、乙两套装置的集气瓶中分别通入氧气和空气。 | 铁钉均锈蚀,且 U 型管中液面由 b 处上升至 a 处,所需时间甲___________乙 | 铁的锈蚀速率与氧气的含量有关,氧气的含量越多,铁的锈蚀越快。 |
Ⅲ. | ______________________ | 两套装置中铁钉均锈蚀,且 U 型管中液面均由 b 处上升至 a 处,所需时间甲<乙 | 铁的锈蚀速率与水溶液的导电性有关,在能导电的溶液中,铁的锈蚀速率加快。 |
(反思与提高)根据该探究实验以及你所学的知识,判断下列说法正确的是___________(填序号)。
A 金属的腐蚀是指金属单质与其它物质发生化学反应的过程
B 金属腐蚀不一定要有氧气参加
C 金属越活泼,就越容易被锈蚀
【题目】下列实验操作的现象及相应的结论均正确是( )
实验操作 | 现象 | 结论 | |
A |
小烧杯A中装有蒸馏水(滴有数滴酚酞),B中装有浓氨水 | 一段时间后,A中溶液变蓝色 | 分子在不断运动 |
B | 将螺旋状细铁丝灼烧红热后,立即伸入充满氧气的集气瓶中(瓶底部有少量水) | 细铁丝剧烈燃烧,火星四射,瓶底有黑色固体物质生成 | 铁与氧气反应生成了Fe2O3 |
C | 将一段光亮铜片装在敞口的试管中,用酒精灯火焰加热试管一段时间 | 铜片变黑 | Cu与O2反应生成了CuO |
D | 往集满CO2的软质矿泉水瓶里注入约1/3瓶蒸馏水,立即旋紧瓶盖,充分振荡 | 矿泉水瓶不变瘪 | CO2与水不反应 |
A. A B. B C. C D. D
【题目】学习了MnO2对过氧化氢分解有催化作用的知识后.某同学想:Fe2O3能否起到类似MnO2的催化剂作用呢?于是进行了以下探究.
(猜想)I.Fe2O3是反应的催化剂,反应前后__;
II.Fe2O3参与反应产生O2,反应前后质量和化学性质发生了改变;
III.Fe2O3不是催化剂、也不参与反应,反应前后质量和化学性质不变.
(查阅资料)Fe2O3属于碱性氧化物,能够与稀盐酸反应生成氯化铁;氯化铁溶液显棕黄色.
(实验)用天平称量 0.3gFe2O3,取5mL5%的过氧化氢溶液于试管中,进行如下实验:
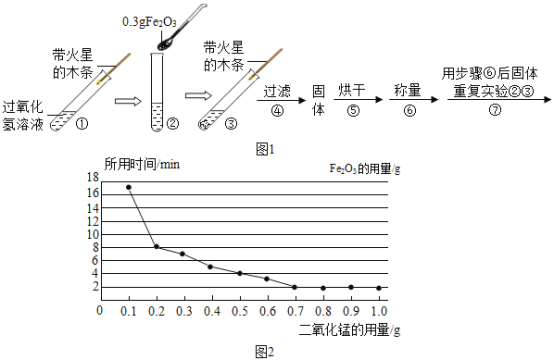
(1)填写下表:
步骤③现象 | 步骤⑥结果 | 步骤⑦现象 | 结论 |
__,带火星的木条复燃. | __ | 溶液中有气泡放出, __ | 猜想I成立; 猜想II、III不成立. |
(2)步骤①的目的是__.
(3)步骤④需用到的实验仪器有:铁架台(带铁圈)、漏斗、烧杯、__.
(4)过氧化氢能被Fe2O3催化分解放出O2的化学方程式为__.
(拓展)
(1)要探究步骤⑤做过催化剂的Fe2O3其它化学性质,还应补做的实验是__(写一种).
(2)该同学为了探究Fe2O3的用量对H2O2分解速率的影响.每次均用30mL 10%的H2O2溶液,使用不同质量的Fe2O3作催化剂,测定每次收集到500mL O2所用的时间.结果如图(其他实验条件相同),由图可知,Fe2O3的用量对H2O2分解速率影响的规律是:
①__;
②Fe2O3的用量超出一定范围后,其用量再增大,反应速率不再继续加快.