题目内容
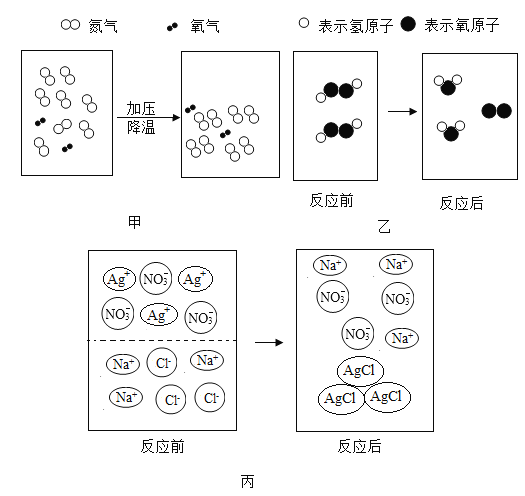
【题目】有Zn、Cu、Ag、Zn(NO3)2溶液、Cu(NO3)2溶液、AgNO3溶液几种物质。
(1)Zn(NO3)2溶液中的溶质是_____。
(2)上述六种物质之间相互可以发生_____个置换反应。若要验证Zn、Cu、Ag三种金属的金属活泼性强弱,可选择上述物质中的Zn、Ag及_____溶液,也可以选择Cu及_____两种溶液。
(3)向含有AgNO3和Cu(NO3)2两种溶质的溶液中加入一定量的Zn,充分反应后过滤、洗涤,分别得到滤渣和滤液。若向滤渣中加入稀盐酸有气泡产生,则滤液中的溶质是_____;若向滤液中滴加稀盐酸,有白色沉淀生成,则此滤液中含有_____种溶质。
【答案】Zn(NO3)2 3 Cu(NO3)2 Zn(NO3)2溶液、AgNO3溶液 Zn(NO3)2 3
【解析】
(1)Zn(NO3)2溶液中的溶质是Zn(NO3)2;
(2)Zn、Cu、Ag、Zn(NO3)2溶液、Cu(NO3)2溶液、AgNO3溶液几种物质之间可以发生3个置换反应,即![]() ,
,![]() ,
,![]() 。若要验证Zn、Cu、Ag三种金属的金属活泼性强弱,可选择上述物质中的Zn、Ag及Cu(NO3)2溶液,也可以选择Cu及Zn(NO3)2溶液、AgNO3溶液。
。若要验证Zn、Cu、Ag三种金属的金属活泼性强弱,可选择上述物质中的Zn、Ag及Cu(NO3)2溶液,也可以选择Cu及Zn(NO3)2溶液、AgNO3溶液。
(3)向含有AgNO3和Cu(NO3)2两种溶质的溶液中加入一定量的Zn,Zn会和AgNO3和Cu(NO3)2反应,化学方程式为:![]() ,
,![]() 。若向滤渣中加入稀盐酸有气泡产生,说明Zn有剩余,全部将Cu和Ag置换出来,则滤液中的溶质只有Zn(NO3)2;若向滤液中滴加稀盐酸,有白色沉淀生成,则此滤液中仍含有AgNO3,说明Zn少量,只将部分Ag置换出来,所以滤液中的溶质为Zn(NO3)2、AgNO3和Cu(NO3)2 3种。
。若向滤渣中加入稀盐酸有气泡产生,说明Zn有剩余,全部将Cu和Ag置换出来,则滤液中的溶质只有Zn(NO3)2;若向滤液中滴加稀盐酸,有白色沉淀生成,则此滤液中仍含有AgNO3,说明Zn少量,只将部分Ag置换出来,所以滤液中的溶质为Zn(NO3)2、AgNO3和Cu(NO3)2 3种。

【题目】研究金属的腐蚀对资源的利用和保护意义重大。
(1)为了探究铁锈蚀的条件,进行如图 1 所示实验。
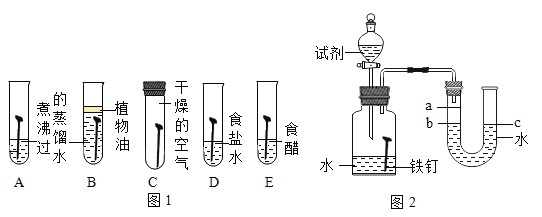
①通过观察实验 A、B、C 中的现象,经过科学严谨的推理得出结论:铁锈蚀是铁与____________发生化学反应的过程。
②实验 D 和 E 的目的是进一步探究铁在盐溶液和酸的环境中是否更容易锈蚀。铁跟醋酸(CH3COOH) 反 应生成醋酸亚铁[ (CH3COO)2Fe ]和氢气 ,请写出反应的化学方程式____________________。
(2)家中的刀具若沾有食盐水锈蚀更快。为了进一步探究影响铁锈蚀速率的因素,做了如下的实验。
(提出问题)铁锈蚀速率与哪些因素有关。
(查阅资料)氯化钠溶液能导电;乙醇溶液不能导电。
(猜想假设)铁的锈蚀速率与下列因素有关:
I._________________;
II.氧气的含量;
Ⅲ.水溶液的导电性。
(实验探究)每次取两套如图 2 所示的装置,编号为甲、乙。向两套装置中分别装入质量、大小相同的铁钉和等体积的蒸馏水,进行如下三组对比实验(实验开始时,各瓶内气体压强保持一致)。
影响 因素 | 实验设计 | 实验现象 | 实验结论及解释 |
I. | 装置甲放入 25℃恒温环境中, 装置乙放入 40℃恒温环境中。 | 两套装置中铁钉均锈蚀,且 U型管中液面均由 b 处上升至 a处,所需时间甲>乙 | ____________ |
II. | 在相同温度下,向甲、乙两套装置的集气瓶中分别通入氧气和空气。 | 铁钉均锈蚀,且 U 型管中液面由 b 处上升至 a 处,所需时间甲___________乙 | 铁的锈蚀速率与氧气的含量有关,氧气的含量越多,铁的锈蚀越快。 |
Ⅲ. | ______________________ | 两套装置中铁钉均锈蚀,且 U 型管中液面均由 b 处上升至 a 处,所需时间甲<乙 | 铁的锈蚀速率与水溶液的导电性有关,在能导电的溶液中,铁的锈蚀速率加快。 |
(反思与提高)根据该探究实验以及你所学的知识,判断下列说法正确的是___________(填序号)。
A 金属的腐蚀是指金属单质与其它物质发生化学反应的过程
B 金属腐蚀不一定要有氧气参加
C 金属越活泼,就越容易被锈蚀
【题目】学习了MnO2对过氧化氢分解有催化作用的知识后.某同学想:Fe2O3能否起到类似MnO2的催化剂作用呢?于是进行了以下探究.
(猜想)I.Fe2O3是反应的催化剂,反应前后__;
II.Fe2O3参与反应产生O2,反应前后质量和化学性质发生了改变;
III.Fe2O3不是催化剂、也不参与反应,反应前后质量和化学性质不变.
(查阅资料)Fe2O3属于碱性氧化物,能够与稀盐酸反应生成氯化铁;氯化铁溶液显棕黄色.
(实验)用天平称量 0.3gFe2O3,取5mL5%的过氧化氢溶液于试管中,进行如下实验:
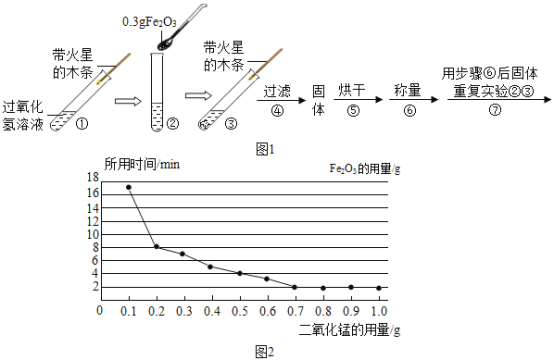
(1)填写下表:
步骤③现象 | 步骤⑥结果 | 步骤⑦现象 | 结论 |
__,带火星的木条复燃. | __ | 溶液中有气泡放出, __ | 猜想I成立; 猜想II、III不成立. |
(2)步骤①的目的是__.
(3)步骤④需用到的实验仪器有:铁架台(带铁圈)、漏斗、烧杯、__.
(4)过氧化氢能被Fe2O3催化分解放出O2的化学方程式为__.
(拓展)
(1)要探究步骤⑤做过催化剂的Fe2O3其它化学性质,还应补做的实验是__(写一种).
(2)该同学为了探究Fe2O3的用量对H2O2分解速率的影响.每次均用30mL 10%的H2O2溶液,使用不同质量的Fe2O3作催化剂,测定每次收集到500mL O2所用的时间.结果如图(其他实验条件相同),由图可知,Fe2O3的用量对H2O2分解速率影响的规律是:
①__;
②Fe2O3的用量超出一定范围后,其用量再增大,反应速率不再继续加快.