题目内容
【题目】小政同学在复习Ca(OH)2化学性质时,归纳出了Ca(OH)2与其它物质间相互反应的关系如图(图中“﹣﹣”表示相连的两种物质能发生反应)。

(1)若X是与其它三种不同类别的化合物,则X可以是_____。
(2)根据图所示的物质间关系,写出其中两个化学方程式:
①_____; ②_____。
【答案】CO2 Ca(OH)2+2HCl=CaCl2+2H2O Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
【解析】
根据碱的化学性质,碱能与酸反应,碱能与盐反应,碱能与酸性氧化物反应可解答此题;
(1)因为我们学过碱的化学性质,碱能与酸反应,碱能与盐反应,碱能与酸性氧化物反应,又因为盐酸属于酸,碳酸钠属于盐,就少了酸性氧化物反应这种类型,所以我们可以选择学过的最常见的酸性氧化物二氧化碳;
(2)根据复分解反应发生的实质,氢氧化钙与盐酸反应生成氯化钙和水,碳酸钠与氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,化学方程式为:①Ca(OH)2+2HCl=CaCl2+2H2O,②Na2CO3+Ca(OH)2=CaCO3↓+2NaOH。

【题目】学习了MnO2对过氧化氢分解有催化作用的知识后.某同学想:Fe2O3能否起到类似MnO2的催化剂作用呢?于是进行了以下探究.
(猜想)I.Fe2O3是反应的催化剂,反应前后__;
II.Fe2O3参与反应产生O2,反应前后质量和化学性质发生了改变;
III.Fe2O3不是催化剂、也不参与反应,反应前后质量和化学性质不变.
(查阅资料)Fe2O3属于碱性氧化物,能够与稀盐酸反应生成氯化铁;氯化铁溶液显棕黄色.
(实验)用天平称量 0.3gFe2O3,取5mL5%的过氧化氢溶液于试管中,进行如下实验:
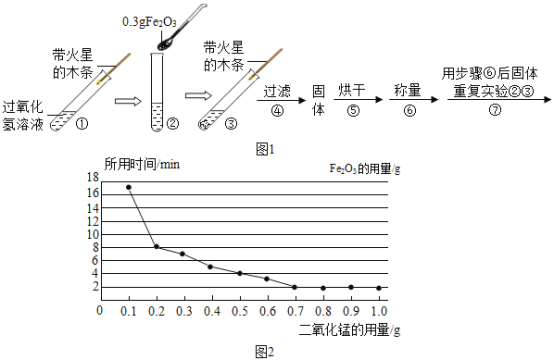
(1)填写下表:
步骤③现象 | 步骤⑥结果 | 步骤⑦现象 | 结论 |
__,带火星的木条复燃. | __ | 溶液中有气泡放出, __ | 猜想I成立; 猜想II、III不成立. |
(2)步骤①的目的是__.
(3)步骤④需用到的实验仪器有:铁架台(带铁圈)、漏斗、烧杯、__.
(4)过氧化氢能被Fe2O3催化分解放出O2的化学方程式为__.
(拓展)
(1)要探究步骤⑤做过催化剂的Fe2O3其它化学性质,还应补做的实验是__(写一种).
(2)该同学为了探究Fe2O3的用量对H2O2分解速率的影响.每次均用30mL 10%的H2O2溶液,使用不同质量的Fe2O3作催化剂,测定每次收集到500mL O2所用的时间.结果如图(其他实验条件相同),由图可知,Fe2O3的用量对H2O2分解速率影响的规律是:
①__;
②Fe2O3的用量超出一定范围后,其用量再增大,反应速率不再继续加快.
【题目】在探究铝化学性质时发现铝与稀盐酸反应比与稀硫酸反应剧烈,化学兴趣小组进行了如下探究:
(1)铝与稀盐酸反应的化学方程式为_____。
(2)铝片使用前需要打磨的原因是_____,铝能被用来制作导线是因为其具有_____性。
(3)实验过程中,可以通过观察_____来比较铝与稀盐酸和稀硫酸反应的剧烈程度。
(4)(作出猜想)猜想一:Cl-对反应起了促进作用;
猜想二:SO![]() 对反应起了阻碍作用;
对反应起了阻碍作用;
猜想三:以上两种猜想同时成立。
(进行实验)
实验 | 实验操作 |
实验1 | 将铝片加入到10mLpH=1的稀盐酸中,然后向其中滴加CuSO4溶液 |
实验2 | 将铝片加入到10mLpH=1的稀硫酸中,然后向其中滴加浓盐酸 |
实验3 | 将铝片加入到10mLpH=1的稀盐酸中,然后向其中滴加Na2SO4溶液 |
(分析并得出结论)
①同学们认为实验1不可行,理由是_____。
②同学们认为实验2思路不正确,改进的方法是_____。
③实验3没有明显现象,证明猜想_____不成立。