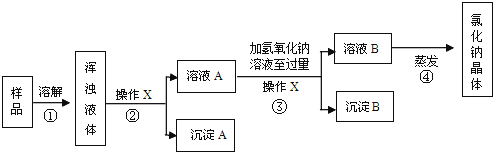
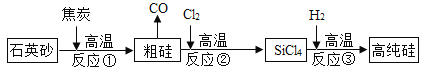
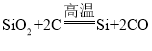题目内容
【题目】某研究小组为探究“铁钉在不同溶液中腐蚀的速率”,在相同条件下取同浓度的下列不同溶液用如图装置完成实验,并用手持数据采集器进行测定。回答下列问题:
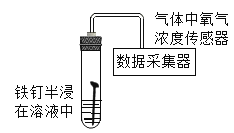
所用溶液 | NH4Cl | (NH4)2SO4 | NH4NO3 |
0min时氧气浓度(%) | 20.8 | 20.8 | 20.8 |
500min时氧气浓度(%) | 15.8 | 17.0 | 17.4 |
实验前溶液PH | 5.31 | 5.53 | 5.50 |
实验后溶液PH | 7.37 | 7.99 | 8.22 |
铁钉表面锈蚀情况 | 大量铁锈 | 大量铁锈 | 大量铁锈 |
(1)用稀硫酸去除铁锈的化学反应方程式为_____
(2)在NH4Cl、(NH4)2SO4、和NH4NO3溶液中,铁钉锈蚀过程中上述溶液的酸性均变_____(填“强”或“弱”)
(3)上述实验方案是否合理?_____(填“合理”或“不合理”),你的理由是_____
(4)铁钉锈蚀的速率还可能与_____有关。请设计你的实验,验证你的猜想:
实验操作 | 实验现象及结论 |
_____ | _____ |
(注意:若答对第(5)小题奖励4分,化学试卷总分不超过60分)
(span>5)该小组在不同酸碱性溶液中又进行了探究,在相同条件下其测定的实验数据如下图:
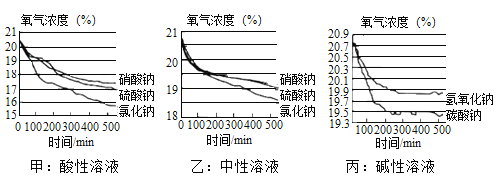
a、上述实验中,氧气浓度下降先陡后缓的原因为_____
b、根据甲、乙图像,请写出三点结论:
①结论:_____②结论:_____③结论:_____
【答案】Fe2 O3 +3H2SO4=Fe2(SO4)2+3H2O 弱 不合理 本题探究的是铁在不同种溶液中锈蚀情况,本实验所用样本都是弱酸性的,样本偏小,缺少中性、碱性溶液作对比 酸性溶液 取两根铁钉,把其中一个铁钉在稀盐酸中浸泡一下,取出,分别放入敞口的试管中,观察现象 铁钉都生锈,用盐酸浸泡的铁钉生锈更快,所以酸性溶液中铁生锈更快 生锈速度变慢了 整体上,3条曲线均出现先陡后缓的走势,说明吸氧腐蚀速率先快后慢 在500min内,铁钉的吸氧腐蚀程度是酸性溶液>中性溶液 500min内吸氧腐蚀的平均速率的大小顺序与腐蚀程度一致
【解析】
(1)氧化铁和硫酸反应生成硫酸铁和水。
(2)在氯化铵、硫酸铵和NH4NO3溶液中,铁钉锈蚀过程中,因为pH都变大,上述溶液的酸性均变弱。
(3)上述实验方案不合理,理由是:本题探究的是铁在不同种溶液中锈蚀情况,本实验所用样本都是弱酸性的,样本偏小,缺少中性、碱性溶液作对比。
(4)铁钉锈蚀的速率还可能与酸性溶液有关,设计实验:取两根铁钉,把其中一个铁钉在稀盐酸中浸泡一下,取出,分别放入敞口的试管中,观察现象,铁钉都生锈,用盐酸浸泡的铁钉生锈更快,所以酸性溶液中铁生锈更快。
(5) a、上述实验中,氧气浓度下降先陡后缓的原因为:生锈速度变慢了;
b、根据甲、乙图像,得出三点结论:
整体上,3条曲线均出现先陡后缓的走势,说明吸氧腐蚀速率先快后慢;
在500min内,铁钉的吸氧腐蚀程度是酸性溶液>中性溶液;
500min内吸氧腐蚀的平均速率的大小顺序与腐蚀程度一致。
(1)氧化铁和硫酸反应生成硫酸铁和水,化学方程式为Fe2 O3 +3H2SO4=Fe2(SO4)2+3H2O。
(2)在氯化铵、硫酸铵和NH4NO3溶液中,铁钉锈蚀过程中,因为pH都变大,上述溶液的酸性均变弱。
(3)上述实验方案不合理;理由是:本题探究的是铁在不同种溶液中锈蚀情况,本实验所用样本都是弱酸性的,样本偏小,缺少中性、碱性溶液作对比。
(4)铁钉锈蚀的速率还可能与酸性溶液有关;设计实验:取两根铁钉,把其中一个铁钉在稀盐酸中浸泡一下,取出,分别放入敞口的试管中,观察现象;铁钉都生锈,用盐酸浸泡的铁钉生锈程度更快,所以酸性溶液中铁生锈更快。
(5) a、上述实验中,氧气浓度下降先陡后缓的原因为:生锈速度变慢了;
b、根据甲、乙图像,得出三点结论:
整体上,3条曲线均出现先陡后缓的走势,说明吸氧腐蚀速率先快后慢;
在500min内,铁钉的吸氧腐蚀程度是酸性溶液>中性溶液;
500min内吸氧腐蚀的平均速率的大小顺序与腐蚀程度一致。

 阶梯计算系列答案
阶梯计算系列答案