题目内容
【题目】碳酸锂广泛应用于陶瓷和医药等领域。工业上通常以β一锂辉石〔主要成分为Li2O·Al2 O3·4SiO2)为原料制备Li2CO3,工艺流程如图所示。
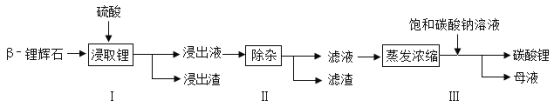
(1)已知硫酸浸后得到的浸出液中含硫酸锂、硫酸铝等物质,则该变化属于_______变化。(填“物理”或 “化学”)
(2)已知硫酸锂(Li2SO3)与碳酸钠发生复分解反应,写出化学方程式_______。
(3)检验碳酸锂中碳酸根时,所需试剂是_______。
【答案】化学 Li2SO4+Na2CO3=Na2SO4+Li2CO3↓ 稀盐酸、澄清石灰水
【解析】
(1)已知硫酸浸后得到的浸出液中含硫酸锂、硫酸铝等物貭,有新物质生成,则该变化属于化学变化。
(2)已知硫酸锂(Li2SO4)与碳酸钠发生复分解反应,结合复分解反应的书写方法“内项结合,外项结合”,故化学方程式Li2SO4+Na2CO3=Na2SO4+Li2CO3↓。
(3)检验碳酸锂中碳酸根时,先加稀盐酸产生气泡,将气体通入澄清石灰水中,石灰水变浑浊,故所需试剂是澄清石灰水、稀盐酸。
故答案为:
(1)化学。(2)Li2SO4+Na2CO3=Na2SO4+Li2CO3↓.(3)稀盐酸、澄清石灰水。

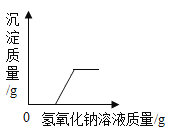
【题目】(9分)某学习小组的同学做实验,向盛有少量氢氧化钠溶液的试管中通入二氧化碳,未看到明显的实验现象。

【提出问题】氢氧化钠能否与二氧化碳反应?
【猜想与假设】亮亮同学认为氢氧化钠能与二氧化碳反应;莉莉同学认为氢氧化钠不能与二氧化碳反应。
【设计与实验】亮亮同学设计了两个装置并进行实验。请你和他一起验证他的猜想。
实验步骤 | 实验现象 | 实验结论 |
如图一,将收集满二氧化碳的试管倒置于氢氧化钠溶液中 | ||
如图二, |
【反思与评价】莉莉同学提出质疑,认为上述现象可能是二氧化碳溶于水的结果。
【设计与实验】请你设计一个实验,证明氢氧化钠确实与二氧化碳反应。
实验步骤 | 实验现象 | 实验结论 |
氢氧化钠与二氧化碳反应 |
【交流与提高】实验证明氢氧化钠还能与二氧化硫反应,化学方程式为:
2NaOH+SO2=X+H2O,X的化学式是 。
【题目】某研究小组为探究“铁钉在不同溶液中腐蚀的速率”,在相同条件下取同浓度的下列不同溶液用如图装置完成实验,并用手持数据采集器进行测定。回答下列问题:
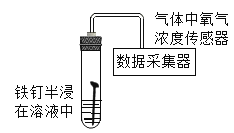
所用溶液 | NH4Cl | (NH4)2SO4 | NH4NO3 |
0min时氧气浓度(%) | 20.8 | 20.8 | 20.8 |
500min时氧气浓度(%) | 15.8 | 17.0 | 17.4 |
实验前溶液PH | 5.31 | 5.53 | 5.50 |
实验后溶液PH | 7.37 | 7.99 | 8.22 |
铁钉表面锈蚀情况 | 大量铁锈 | 大量铁锈 | 大量铁锈 |
(1)用稀硫酸去除铁锈的化学反应方程式为_____
(2)在NH4Cl、(NH4)2SO4、和NH4NO3溶液中,铁钉锈蚀过程中上述溶液的酸性均变_____(填“强”或“弱”)
(3)上述实验方案是否合理?_____(填“合理”或“不合理”),你的理由是_____
(4)铁钉锈蚀的速率还可能与_____有关。请设计你的实验,验证你的猜想:
实验操作 | 实验现象及结论 |
_____ | _____ |
(注意:若答对第(5)小题奖励4分,化学试卷总分不超过60分)
(span>5)该小组在不同酸碱性溶液中又进行了探究,在相同条件下其测定的实验数据如下图:
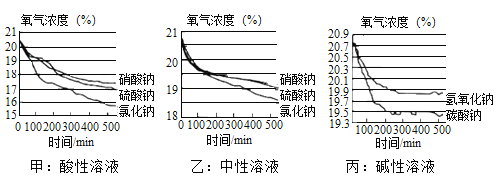
a、上述实验中,氧气浓度下降先陡后缓的原因为_____
b、根据甲、乙图像,请写出三点结论:
①结论:_____②结论:_____③结论:_____
【题目】小明同学在做铝和稀盐酸反应时无意中加入几滴硫酸铜溶液,发现铝片表面产生气泡速率明显增快,对此他产生了兴趣。
(提出问题)硫酸铜溶液是不是此反应的催化剂?硫酸铜溶液的体积对此实验有影响吗?
(设计并实验)室温下,小明将过量、表面积相同已打磨的铝片分别加入到6份30mL10%稀盐酸中,并在每份中加入不同体积的硫酸铜饱和溶液,记录获得相同体积氢气的时间,从而确定产生氢气的速率。
实验混合溶液 | 1 | 2 | 3 | 4 | 5 | 6 |
饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | 10 | 20 |
水/mL | 20 | 19.5 | 17.5 | V | 10 | 0 |
(1)上述表格中V=______________。
(2)写出铝和稀盐酸反应的化学方程式:______________。
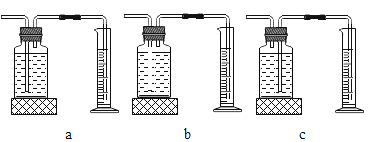
(3)定量收集氢气体积可用如图________(填写字母序号)装置。
(实验现象)随着硫酸铜溶液体积的增加,产生氢气的速率先加快后明显减慢,且铝片表面附着的红色物质逐渐增加。
(结论与解释)
(4)随着硫酸铜溶液体积的增加,反应速率明显变慢可能的原因是___
(5)根据实验现象小明认为硫酸铜溶液不是此反应的催化剂,其原因是___
(实验反思)加速铝和稀盐酸反应速率还可以采取的措施是___(写出一点)
(注意:若正确回答下列各题奖励4分,化学总分不超过60分)
(实验拓展)根据上述实验,小明认为是盐中的金属离子影响了铝和稀盐酸的反应速率;为了研究不同金属离子对反应的影响,小明同学继续实验,取过量表面积相同的铝片和30mL10%稀盐酸混合后加入不同的盐溶液,实验现象如表(加号越多,代表反应速率越快):
实验1 | 实验2 | 实验3 | 实验4 | 实验5 | |
加入试剂0.5mL | 水 | 5%NaCl溶液 | 5%Mg2(NO)3溶液 | 5%FeSO4溶液 | 5%CuSO4溶液 |
产生气泡速率 | + | + | + | ++ | +++ |
(6)如表中,用水进行实验的目的是_________;
(7)上述实验设计存有缺陷,该缺陷是;改进实验后,仍符合上表中的实验现象,可得到的结论是:①______________;②______________.