题目内容
【题目】供氧呼吸面具中的制氧剂主要成分是过氧化钠(Na2O2)。同学们用过氧化钠代替制氧剂在呼吸面具中使用一段时间后,对固体成分展开研究。
(查阅资料)Na2O2能分别与H2O和CO2反应生成O2,并放出大量的热量。方程式分别为:2Na2O2+2H2O═4NaOH+O2↑ 2Na2O2+2CO2═2Na2CO3+O2↑
(猜想假设)固体可能为:a Na2O2和NaOH b Na2O2和Na2CO3 c Na2O2、NaOH和Na2CO3 d NaOH和Na2CO3 e Na2CO3
根据呼吸面具中发生的反应,你认为上述哪个猜想最不合理,并说明理由。__。
(定性研究)
实验Ⅰ:取少量固体于试管中,加足量水,___,证明固体中有Na2O2。
实验Ⅱ:取少量固体于试管中,滴加足量稀盐酸,产生大量气泡,证明固体中含有Na2CO3。
实验Ⅲ:取少量固体于试管中,加足量水,再滴加足量的氯化钙溶液,过滤,向滤液中加入硫酸铜溶液,____,证明固体中含有NaOH。
(反思评价)上述根据现象得出结论正确的实验是_______。
(定量研究)定性研究遇阻,同学们决定用定量测定法研究该固体成分。
取1.84g固体于烧杯内,加入10g蒸馏水,固体完全溶解后烧杯内物质总质量为11.68g,继续向烧杯中加入澄清石灰水至不再产生沉淀,过滤、洗涤、干燥并称量得固体1.0g。
(实验结论)通过计算,可以得出:猜想假设_____(填字母)成立。
(延伸拓展)
(1)由上述数据可算出样品中Na2O2的含量,但结果往往偏大,可能的原因是_____。
(2)现有质量为M的CO、H2的混合气体,将其充分燃烧后的产物通过足量的质量为N的Na2O2固体,充分反应后固体质量为_____。
【答案】猜想a不合理,人呼出的气体中含有CO2,与Na2O2反应生成Na2CO3,因此固体中一定含有Na2CO3 产生气泡 产生蓝色沉淀 Ⅰ b Na2O2与水反应放热,使得氧气中含有水蒸气,测得氧气的质量偏大 M+N
【解析】
[猜想与假设]
根据人呼吸的气体中含有水和二氧化碳可知,水和二氧化碳都能与Na2O2反应,因此固体中不可能只含有Na2O2和NaOH。故填:猜想a不合理,人呼出的气体中含有CO2,与Na2O2反应生成Na2CO3,因此固体中一定含有Na2CO3
[定性研究]
实验I:因为2Na2O2+2H2O=4NaOH+O2↑,取少量固体放入试管中,加足量水,看到固体溶解,有气泡产生(或将带火星的木条伸入试管中,木条复燃),证明固体中有Na2O2。故填:有气泡产生
实验Ⅲ:因为碳酸钠与氯化钙溶液反应生成碳酸钙沉淀和氯化钠;取少量固体放入试管中,加足量水,再滴加足量的氯化钙溶液后,过滤出碳酸钙,再向滤液中加入硫酸铜试液,若溶液产生蓝色沉淀,则证明原固体中含有NaOH。故填:产生蓝色沉淀
[反思评价]
通过实验Ⅱ并不能确定固体中含有Na2CO3;因为Na2O2也能与酸反应产生气泡,通过实验Ⅲ也不能证明固体中一定含有NaOH.其原因是:2Na2O2+2H2O=4NaOH+O2↑,影响氢氧化钠的判定;上述根据现象得出结论正确的实验是实验I;故填:I
[实验结论]
根据过氧化钠与水反应能生成氢氧化钠和氧气,反应前后减少的质量为生成的氧气的质量,氧气的质量=1.84g+10g-11.68g=0.16g;设过氧化钠的质量为x。
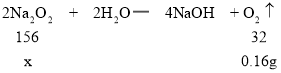
![]()
![]()
假设固体中碳酸钠的质量为y。
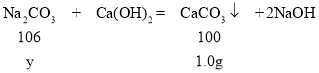
![]()
![]()
Na2O2和Na2CO3的质量和为:0.78g+1.06g=1.84g;而原固体质量为:1.84g;因此可知原固体中,没有NaOH,通过计算,可以得出:猜想假设b成立。故填:b
[延伸拓展]
(1)由上述数据可算出样品中Na2O2的含量,但结果往往偏大,可能的原因是Na2O2与水反应放热,使得氧气中含有水蒸气,测得氧气的质量偏大。故填:Na2O2与水反应放热,使得氧气中含有水蒸气,测得氧气的质量偏大
(2)由化学方程式:2Na2O2+2H2O═4NaOH+O2↑、2Na2O2+2CO2═2Na2CO3+O2↑以及氢气燃烧、一氧化碳燃烧的方程式可知,氢气燃烧、一氧化碳燃烧消耗的氧气的质量等于水、二氧化碳与Na2O2反应产生的氧气的质量,因此质量为M的CO、H2的混合气体,将其充分燃烧后的产物通过足量的质量为N的Na2O2固体,相当于完全把质量为M的气体吸收了,故充分反应后得到的固体质量为:M+N。故填:M+N。

 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案【题目】(9分)某学习小组的同学做实验,向盛有少量氢氧化钠溶液的试管中通入二氧化碳,未看到明显的实验现象。

【提出问题】氢氧化钠能否与二氧化碳反应?
【猜想与假设】亮亮同学认为氢氧化钠能与二氧化碳反应;莉莉同学认为氢氧化钠不能与二氧化碳反应。
【设计与实验】亮亮同学设计了两个装置并进行实验。请你和他一起验证他的猜想。
实验步骤 | 实验现象 | 实验结论 |
如图一,将收集满二氧化碳的试管倒置于氢氧化钠溶液中 | ||
如图二, |
【反思与评价】莉莉同学提出质疑,认为上述现象可能是二氧化碳溶于水的结果。
【设计与实验】请你设计一个实验,证明氢氧化钠确实与二氧化碳反应。
实验步骤 | 实验现象 | 实验结论 |
氢氧化钠与二氧化碳反应 |
【交流与提高】实验证明氢氧化钠还能与二氧化硫反应,化学方程式为:
2NaOH+SO2=X+H2O,X的化学式是 。
【题目】某研究小组为探究“铁钉在不同溶液中腐蚀的速率”,在相同条件下取同浓度的下列不同溶液用如图装置完成实验,并用手持数据采集器进行测定。回答下列问题:
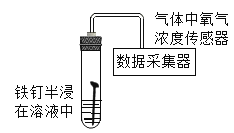
所用溶液 | NH4Cl | (NH4)2SO4 | NH4NO3 |
0min时氧气浓度(%) | 20.8 | 20.8 | 20.8 |
500min时氧气浓度(%) | 15.8 | 17.0 | 17.4 |
实验前溶液PH | 5.31 | 5.53 | 5.50 |
实验后溶液PH | 7.37 | 7.99 | 8.22 |
铁钉表面锈蚀情况 | 大量铁锈 | 大量铁锈 | 大量铁锈 |
(1)用稀硫酸去除铁锈的化学反应方程式为_____
(2)在NH4Cl、(NH4)2SO4、和NH4NO3溶液中,铁钉锈蚀过程中上述溶液的酸性均变_____(填“强”或“弱”)
(3)上述实验方案是否合理?_____(填“合理”或“不合理”),你的理由是_____
(4)铁钉锈蚀的速率还可能与_____有关。请设计你的实验,验证你的猜想:
实验操作 | 实验现象及结论 |
_____ | _____ |
(注意:若答对第(5)小题奖励4分,化学试卷总分不超过60分)
(span>5)该小组在不同酸碱性溶液中又进行了探究,在相同条件下其测定的实验数据如下图:
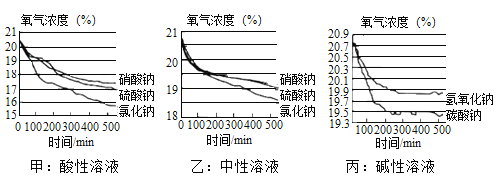
a、上述实验中,氧气浓度下降先陡后缓的原因为_____
b、根据甲、乙图像,请写出三点结论:
①结论:_____②结论:_____③结论:_____