题目内容
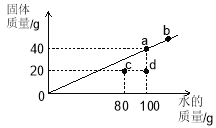
【题目】实验室制取气体的装置如图所示,请回答下列问题:
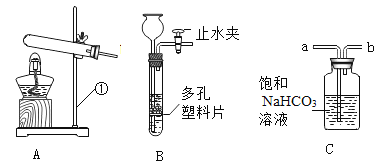
(1)仪器①的名称是_____。
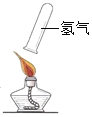
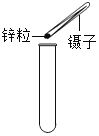
(2)氢气是种无色、无味、难溶于水的气体密度比空气小、在实验室中常用锌粒和稀硫酸反应制取,则制取氢气的发生装置应选择_____(填字母);氢气与氧气混合点燃可能会发生爆炸,因此点燃氢气之前必须先_______。
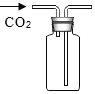
(3)实验室若用B装置制取CO2,反应的化学方程式为_____,制取的二氧化碳气体中常混有少量氯化氢气体,需用饱和碳酸氢钠溶液将杂质气体除去,则气体应从_____(填·“a”或"b”)端进入。
【答案】铁架台 B 检验纯度 CaCO3+2HCl=CaCl2+H2O+CO2↑ a
【解析】
(1)通过分析题中所指仪器的名称和作用可知,①是铁架台;
(2)实验室制取氢气的反应物是固体和液体,反应条件是常温,所以制取氢气的发生装置应选择B,氢气与氧气混合点燃可能会发生爆炸,因此点燃氢气之前必须先检验纯度;
(3)碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑,洗气应该长进短出,用饱和碳酸氢钠溶液将杂质气体除去氯化氢,则气体应从a端进入。
故答案为:(1)铁架台;
(2)B,检验纯度;
(3)CaCO3+2HCl=CaCl2+H2O+CO2↑,a。

 轻松暑假总复习系列答案
轻松暑假总复习系列答案【题目】某研究小组为探究“铁钉在不同溶液中腐蚀的速率”,在相同条件下取同浓度的下列不同溶液用如图装置完成实验,并用手持数据采集器进行测定。回答下列问题:
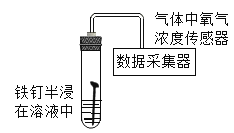
所用溶液 | NH4Cl | (NH4)2SO4 | NH4NO3 |
0min时氧气浓度(%) | 20.8 | 20.8 | 20.8 |
500min时氧气浓度(%) | 15.8 | 17.0 | 17.4 |
实验前溶液PH | 5.31 | 5.53 | 5.50 |
实验后溶液PH | 7.37 | 7.99 | 8.22 |
铁钉表面锈蚀情况 | 大量铁锈 | 大量铁锈 | 大量铁锈 |
(1)用稀硫酸去除铁锈的化学反应方程式为_____
(2)在NH4Cl、(NH4)2SO4、和NH4NO3溶液中,铁钉锈蚀过程中上述溶液的酸性均变_____(填“强”或“弱”)
(3)上述实验方案是否合理?_____(填“合理”或“不合理”),你的理由是_____
(4)铁钉锈蚀的速率还可能与_____有关。请设计你的实验,验证你的猜想:
实验操作 | 实验现象及结论 |
_____ | _____ |
(注意:若答对第(5)小题奖励4分,化学试卷总分不超过60分)
(span>5)该小组在不同酸碱性溶液中又进行了探究,在相同条件下其测定的实验数据如下图:
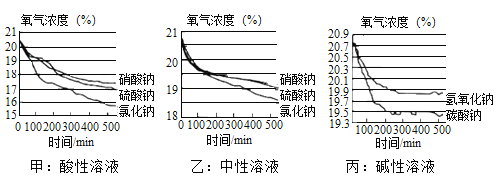
a、上述实验中,氧气浓度下降先陡后缓的原因为_____
b、根据甲、乙图像,请写出三点结论:
①结论:_____②结论:_____③结论:_____
【题目】小明同学在做铝和稀盐酸反应时无意中加入几滴硫酸铜溶液,发现铝片表面产生气泡速率明显增快,对此他产生了兴趣。
(提出问题)硫酸铜溶液是不是此反应的催化剂?硫酸铜溶液的体积对此实验有影响吗?
(设计并实验)室温下,小明将过量、表面积相同已打磨的铝片分别加入到6份30mL10%稀盐酸中,并在每份中加入不同体积的硫酸铜饱和溶液,记录获得相同体积氢气的时间,从而确定产生氢气的速率。
实验混合溶液 | 1 | 2 | 3 | 4 | 5 | 6 |
饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | 10 | 20 |
水/mL | 20 | 19.5 | 17.5 | V | 10 | 0 |
(1)上述表格中V=______________。
(2)写出铝和稀盐酸反应的化学方程式:______________。
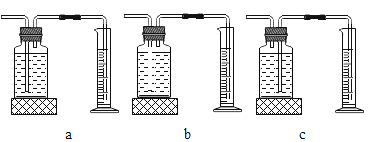
(3)定量收集氢气体积可用如图________(填写字母序号)装置。
(实验现象)随着硫酸铜溶液体积的增加,产生氢气的速率先加快后明显减慢,且铝片表面附着的红色物质逐渐增加。
(结论与解释)
(4)随着硫酸铜溶液体积的增加,反应速率明显变慢可能的原因是___
(5)根据实验现象小明认为硫酸铜溶液不是此反应的催化剂,其原因是___
(实验反思)加速铝和稀盐酸反应速率还可以采取的措施是___(写出一点)
(注意:若正确回答下列各题奖励4分,化学总分不超过60分)
(实验拓展)根据上述实验,小明认为是盐中的金属离子影响了铝和稀盐酸的反应速率;为了研究不同金属离子对反应的影响,小明同学继续实验,取过量表面积相同的铝片和30mL10%稀盐酸混合后加入不同的盐溶液,实验现象如表(加号越多,代表反应速率越快):
实验1 | 实验2 | 实验3 | 实验4 | 实验5 | |
加入试剂0.5mL | 水 | 5%NaCl溶液 | 5%Mg2(NO)3溶液 | 5%FeSO4溶液 | 5%CuSO4溶液 |
产生气泡速率 | + | + | + | ++ | +++ |
(6)如表中,用水进行实验的目的是_________;
(7)上述实验设计存有缺陷,该缺陷是;改进实验后,仍符合上表中的实验现象,可得到的结论是:①______________;②______________.
【题目】以下是我们日常生活中常用的清洗剂,其名称及有效成分如下表:
![]()
![]()

| 洁厕灵 |
| 污渍爆炸盐 |
有效成分 | 盐酸 | 过氧化氢 | 过碳酸钠 |
(1)清除以下物质,可以使用洁厕灵的是________(填字母序号)。
A.铁锈 B.水垢(主要成分为碳酸钙和氢氧化镁) C.油渍
(2)“活氧彩漂”可用于漂洗衣物、杀菌消毒等,原因是其有效成分过氧化氢分子中含有“过氧基”(—O—O—)。据此推测,下列物质中,可用作杀菌消毒剂的是________(填序号)。
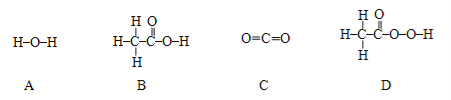
(3)“污渍爆炸盐”溶于水,生成Na2CO3和H2O2。再加入足量的洁厕灵,产生能使澄清石灰水变浑浊的气体,写出产生此气体的化学方程式________。