题目内容
【题目】以下是老师引导学生探究“质量守恒定律”的教学片段,请你参与探究并帮忙填写空格(包括表中的空格)。
[提出问题]化学反应前后各物质的质量总和是否相等?
[查阅资料]氢氧化钠溶液可以吸收二氧化碳气体
[猜想与假设]猜想1:不相等;猜想2:相等。
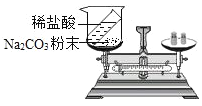
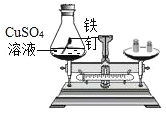
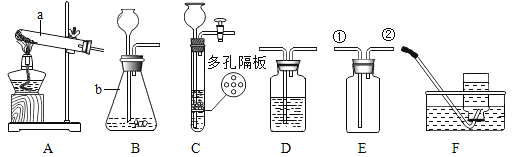
[实验探究]甲、乙两组同学分别按下表中实验方案实验,用托盘天平分别称量反应前后的质量。
甲组 | 乙组 | |
实验方案 |
|
|
实验现象 | 有气泡产生,天平指针向右偏转 | ________________________溶液由蓝色变为浅绿色,天平指针没有偏转 |
· | 猜想1正确 | 猜想2正确,反应的化学方程式:_________________, |
[反思评价]究竟哪种猜想正确?通过讨论,同学们发现甲组中有气体逸出,导致指针向右偏转。得到启示:在探究化学反应前后各物质的质量总和是否相等时,凡有气体生成或参加的反应一定要在______________________中进行。
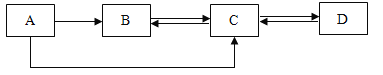
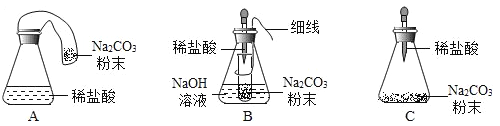
[优化装置]同学们对甲组中的反应装置进行了如下改进,你认为最佳装置是_____________________(填序号)。
[得出结论]同学们利用改进后的最佳装置进行再次探究,均得出猜想2正确。进一步分析发现,反应体系中器材和未参加反应的物质的质量在反应前后保持不变,最终得出结论:________________________的各物质的质最总和等于反应后生成的各物质的质量总和。
[解释应用]
(1)化学反应前后________________________,所以质量守恒。
(2)某固体物质受热会发生分解反应,生成氧化铜、水和二氧化碳三种物质,则该固体物质中一定含有_________________(填元素名称)。
【答案】铁钉表面有红色固体生成 ![]() 密封容器 B 参加反应 原子的种类、数目、质量都没有改变 铜元素、氢元素、氧元素和碳元素
密封容器 B 参加反应 原子的种类、数目、质量都没有改变 铜元素、氢元素、氧元素和碳元素
【解析】
本题利用不同反应原理对质量守恒定律进行探究。
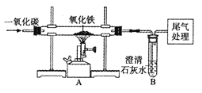
(1)该实验是用硫酸铜溶液和铁钉反应,生成硫酸亚铁和铜,所以观察到的现象是铁钉表面有红色固体生成,溶液由蓝色变成浅绿色。
(2)反应方程式为![]() 。
。
(3)甲组实验中有气体生成并逸出,导致指针向右偏转,质量不相等。得到启示:在探究化学反应前后各物质的质量总和是否相等时,凡有气体生成或参加的反应一定要在密封容器中进行。
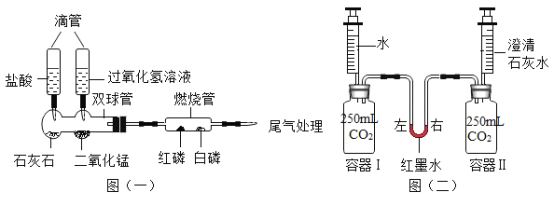
(4)A、盐酸与碳酸钠反应产生二氧化碳气体,使气球膨胀,受到空气的浮力,称量质量偏小,不符合题意;
B、盐酸与碳酸钠反应产生二氧化碳气体,二氧化碳气体会被瓶内氢氧化钠溶液吸收,不会导致瓶内压强增大,气体不会冲脱橡皮塞,符合题意;
C、盐酸与碳酸钠反应产生二氧化碳气体,导致瓶内压强增大,气体冲脱橡皮塞,不符合题意;故选B。
(5)该实验得出结论: 参加反应的各物质的质最总和等于反应后生成的各物质的质量总和。
(6)利用微观知识解释质量守恒定律,化学反应前后原子的种类、数目、质量都没有改变,所以质量守恒。
(7)应用质量守恒定律,在化学反应中元素种类不变。某固体物质受热会发生分解反应,生成氧化铜、水和二氧化碳三种物质,生成物中含有铜元素、氢元素、氧元素和碳元素,则该固体物质中一定含有铜元素、氢元素、氧元素和碳元素。

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
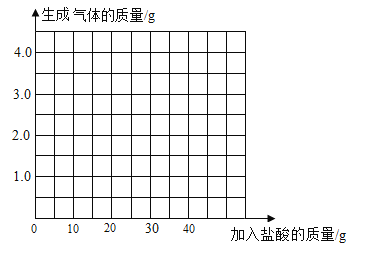
同步拓展阅读系列答案【题目】为了检测某石块样品中碳酸钙的含量,甲、乙、丙、丁四位同学用质量分数相同的盐酸与石块样品充分反应来进行实验测定(样品中的杂质不溶于水,且不与盐酸反应),测得数据如表:
甲同学 | 乙同学 | 丙同学 | 丁同学 | |
所取石块样品质量(g) | 10.0 | 10.0 | 10.0 | 10.0 |
加入盐酸的质量(g) | 10.0 | 20.0 | 30.0 | 40.0 |
烧杯中剩余物质的总质量(g) | 19.0 | 28.0 | 37.8 | 47.8 |
(1)碳酸钙中钙元素的质量分数为__________。
(2)10g石块样品完全反应,产生气体的质量为_________。
(3)求样品中碳酸钙的质量分数______(写出计算过程)。
(4)请在图中画出加入稀盐酸的质量与生成气体的质量的变化关系。_____。