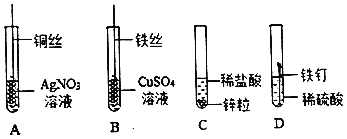
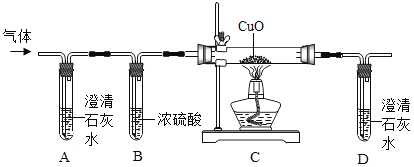
题目内容
【题目】据图回答问题:
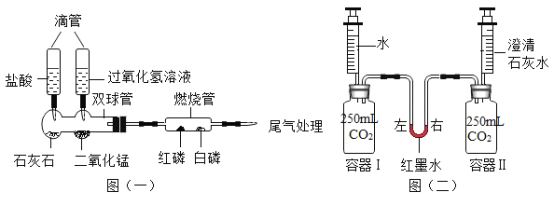
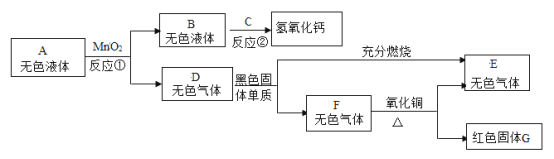
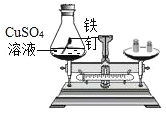
(1)为了验证可燃物燃烧的条件,某同学设计了图(一)实验。装好药品后,操作顺序是_____, (填abc序号)
a.给燃烧管微热至46°C
b.滴入过氧化氢溶液
c.滴入盐酸
(2)如图(二)所示,分别把10mL水和澄清石灰水同时注入容器中,观察到中间U型管内的现象是_____。 写出容器Ⅱ中的化学反应方程式_____。
【答案】cab 左侧红墨水液面降低,右侧升高 CO2+Ca(OH)2=CaCO3↓+H2O
【解析】
(1)为了验证可燃物燃烧的条件,装好药品后,操作顺序是:
c.先滴入盐酸,稀盐酸与石灰水反应产生二氧化碳气体,将装置内的空气排尽,a.再给燃烧管微热至46°C,燃烧管内无明显现象,因为没有助燃物,b最后滴入过氧化氢溶液,产生氧气,燃烧管内白磷(40℃)燃烧,红磷不燃烧;红磷的着火点温度太高(约为240℃),所以不能燃烧;
(2)分别把10mL水和澄清石灰水同时注入容器中,容器Ⅰ中部分二氧化碳与水反应产生碳酸,压强略微减小,容器Ⅱ中大量二氧化碳与氢氧化钙溶液反应,压强明显减小,压强大小关系为:容器Ⅰ>容器Ⅱ;观察到中间U型管左侧红墨水液面降低,右侧升高。 容器Ⅱ中二氧化碳与氢氧化钙反应产生碳酸钙和水的化学反应方程式:CO2+Ca(OH)2=CaCO3↓+H2O。

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案【题目】以下是老师引导学生探究“质量守恒定律”的教学片段,请你参与探究并帮忙填写空格(包括表中的空格)。
[提出问题]化学反应前后各物质的质量总和是否相等?
[查阅资料]氢氧化钠溶液可以吸收二氧化碳气体
[猜想与假设]猜想1:不相等;猜想2:相等。
[实验探究]甲、乙两组同学分别按下表中实验方案实验,用托盘天平分别称量反应前后的质量。
甲组 | 乙组 | |
实验方案 |
|
|
实验现象 | 有气泡产生,天平指针向右偏转 | ________________________溶液由蓝色变为浅绿色,天平指针没有偏转 |
· | 猜想1正确 | 猜想2正确,反应的化学方程式:_________________, |
[反思评价]究竟哪种猜想正确?通过讨论,同学们发现甲组中有气体逸出,导致指针向右偏转。得到启示:在探究化学反应前后各物质的质量总和是否相等时,凡有气体生成或参加的反应一定要在______________________中进行。
[优化装置]同学们对甲组中的反应装置进行了如下改进,你认为最佳装置是_____________________(填序号)。
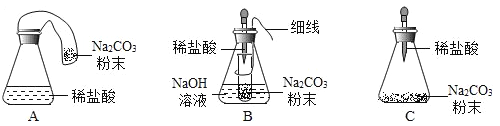
[得出结论]同学们利用改进后的最佳装置进行再次探究,均得出猜想2正确。进一步分析发现,反应体系中器材和未参加反应的物质的质量在反应前后保持不变,最终得出结论:________________________的各物质的质最总和等于反应后生成的各物质的质量总和。
[解释应用]
(1)化学反应前后________________________,所以质量守恒。
(2)某固体物质受热会发生分解反应,生成氧化铜、水和二氧化碳三种物质,则该固体物质中一定含有_________________(填元素名称)。