题目内容
【题目】活动小组为测定由氧化铜和铜组成的混合物中氧化铜的质量分数,现取3份该固体混合物各20g,分别缓慢加入到50 g、100 g、150 g某稀硫酸中,测得三组实验数据如下表:
组别 | 第1组 | 第2组 | 第3组 |
稀硫酸质量/g | 50 | 100 | 150 |
剩余固体的质量/g | 10.0 | 4.0 | 4.0 |
根据实验及有关数据进行分析与计算:
(1)第1组实验中_____________(填“氧化铜”“稀硫酸”或“氧化铜与稀硫酸”)完全反应。
(2)样品中氧化铜的质量分数是__________g。
(3)根据第1组实验数据计算所用的稀硫酸溶质的质量分数__________(写出计算过程)。
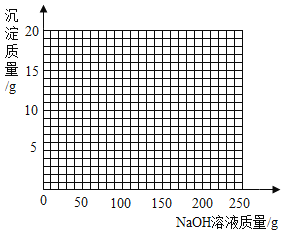
(4)若将第2组实验后的混合物过滤,在滤液中滴加10%的NaOH溶液,请画出在该混合溶液中加入10% NaOH溶液的质量与生成沉淀质量变化关系的曲线图__________。
【答案】稀硫酸 80% 24.5% 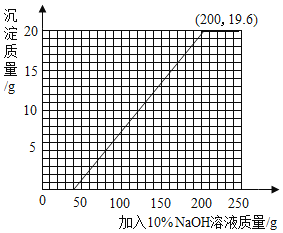
【解析】
(1)样品中的氧化铜和硫酸反应而铜不和硫酸反应,第一组实验50g稀硫酸溶解掉固体的质量是10.0g,第二组实验是100g稀硫酸溶解掉固体的质量是16.0g,由此得出结论,第一组实验酸不足,稀硫酸完全参加了反应;
(2)由上述分析可知,50g稀硫酸完全反应的氧化铜的质量为10g,则100g稀硫酸完全的氧化铜的质量是20g,第二组实验是100g稀硫酸溶解掉固体的质量是20.0g-4.0g=16.0g,说明氧化铜完全参加了反应。氧化铜的质量是16g,样品中氧化铜的质量分数是:
![]() ;
;
(3)设50g稀硫酸的溶质质量为x,则
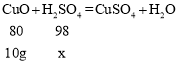
![]() ;
;
所用稀硫酸的溶质质量分数为:
![]() ;
;
(4)设和16g氧化铜反应的稀硫酸质量为y,生成的硫酸铜的质量为z,则
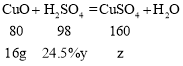
![]()
解得:y=80g,z=32g;
设和(100g-80g)=20g稀硫酸反应的氢氧化钠溶液的质量为m,则
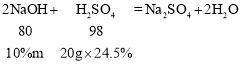
![]() ;
;
因为向有稀硫酸和硫酸铜的溶液中滴加氢氧化钠溶液时,可以看成氢氧化钠溶液先和硫酸反应再和硫酸铜反应,所以我们得到起点坐标(40,0)。
设和生成的硫酸铜反应的氢氧化钠溶液的质量为n,反应生成的沉淀的质量为w,则
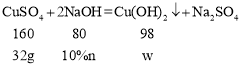
![]()
解得:n=160g,w=19.6g
和剩余的稀硫酸以及硫酸铜反应的氢氧化钠溶液的质量总和是40g+160g=200g,所以我们得到折点坐标(200,19.6),故绘制图象如下图:


 灵星计算小达人系列答案
灵星计算小达人系列答案【题目】铜镁合金常用做飞机天线等导电材料。欲测定合金的组成(其他元素忽略不计),进行如下实验:取铜镁合金10g放入烧杯,将200g稀硫酸分4次加入烧杯中,充分反应后,测得剩余固体的质量记录如下。请计算:
次 数 | 1 | 2 | 3 | 4 |
加入稀硫酸质量/g | 50 | 50 | 50 | 50 |
剩余固体质量/g | 8.5 | 7 | 6.6 | 6.6 |
(1)铜镁合金中铜的质量分数。
(2)求所加稀硫酸中溶质的质量分数。(写出计算过程)
【题目】硫酸锂(Li2SO4)和硝酸钾在不同温度时的溶解度如下表:
温度/℃ | 0 | 10 | 20 | 30 | 40 | |
溶解 度/g | Li2SO4 | 36.1 | 35.4 | 34.8 | 34.3 | 33.9 |
KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | |
请回答下列问题:

(1)依据溶解度表,绘制溶解度曲线如图所示,其中能表示Li2SO4溶解度曲线的是_______(填“甲”或“乙”)。
(2)Li2SO4和KNO3在某一温度时具有相同的溶解度x,则x的范围是_________________。
(3)40℃时,有含少量Li2SO4的KNO3饱和溶液,欲从中提纯KNO3晶体,方法是________________。
(4)将10℃时两种物质的饱和溶液分别升温至30℃,所得Li2SO4溶液中溶质的质量分数__________(填“>”、“<”或“=”)KNO3溶液中溶质的质量分数。
(5)如图所示,20℃时,将盛有饱和Li2SO4溶液的试管放入盛水的烧杯中,向烧杯的水中加入某物质后,试管内有晶体析出。则加入的物质可以是______(填字母序号)。
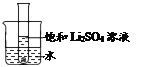
①浓硫酸 ②冰块 ③生石灰固体 ④硝酸铵固体 ⑤氢氧化钠固体
A.②④ B.①③⑤ C.③④ D.①②⑤