题目内容
【题目】硫酸锂(Li2SO4)和硝酸钾在不同温度时的溶解度如下表:
温度/℃ | 0 | 10 | 20 | 30 | 40 | |
溶解 度/g | Li2SO4 | 36.1 | 35.4 | 34.8 | 34.3 | 33.9 |
KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | |
请回答下列问题:

(1)依据溶解度表,绘制溶解度曲线如图所示,其中能表示Li2SO4溶解度曲线的是_______(填“甲”或“乙”)。
(2)Li2SO4和KNO3在某一温度时具有相同的溶解度x,则x的范围是_________________。
(3)40℃时,有含少量Li2SO4的KNO3饱和溶液,欲从中提纯KNO3晶体,方法是________________。
(4)将10℃时两种物质的饱和溶液分别升温至30℃,所得Li2SO4溶液中溶质的质量分数__________(填“>”、“<”或“=”)KNO3溶液中溶质的质量分数。
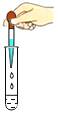
(5)如图所示,20℃时,将盛有饱和Li2SO4溶液的试管放入盛水的烧杯中,向烧杯的水中加入某物质后,试管内有晶体析出。则加入的物质可以是______(填字母序号)。
①浓硫酸 ②冰块 ③生石灰固体 ④硝酸铵固体 ⑤氢氧化钠固体
A.②④ B.①③⑤ C.③④ D.①②⑤
【答案】乙;20℃~30℃;降温结晶;>;B
【解析】
根据固体的溶解度曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的。
(1)依据溶解度表,硫酸锂的溶解度随温度的升高而减小,能表示Li2SO4溶解度曲线的是乙;
(2)通过分析溶解度表中的数据可知,Li2SO4和KNO3在某一温度时具有相同的溶解度x,x的范围是:20℃~30℃;
(3)硝酸钾的溶解度受温度变化影响较大,所以40℃时,有含少量Li2SO4的KNO3饱和溶液,欲从中提纯KNO3晶体,方法是降温结晶;
(4)硝酸钾的溶解度随温度的升高而增大,硫酸锂的溶解度随温度的升高而减小,硫酸锂30℃时的溶解度大于硝酸钾10℃时的溶解度,所以将10℃时两种物质的饱和溶液分别升温至30℃,所得Li2SO4溶液中溶质的质量分数>KNO3溶液中溶质的质量分数;
(5)硫酸锂的溶解度随温度的升高而减小,所以20℃时,将盛有饱和Li2SO4溶液的试管放入盛水的烧杯中,向烧杯的水中加入某物质后,试管内有晶体析出,则加入的物质使溶液温度升高,可以是①浓硫酸、③生石灰固体、⑤氢氧化钠固体。

 同步练习强化拓展系列答案
同步练习强化拓展系列答案【题目】初中化学常见的七种物质A-G,所属物质类别和组成元素的种类如下表。
物质分类 | 单质 | 化合物 | ||
元素种类 | 金属 | 非金属 | 两种 | 三种 |
物质代号 | A、B | C、D | E、F | G |
其中A、B均能与C反应,A与C反应的生成物所含两种元素的质量比是3︰2;B与C反应的生成物组成元素与E相同;C与D反应的生成物常温下为液态,其组成元素与F相同;A、B均能与G溶液反应,且反应后所得溶液的质量均增加。请回答:
(1)C的一种用途是________;E的化学式是________;F所含的元素是________。
(2)写出反应的化学方程式:① B+C________;② C+D________;③ A+G________。
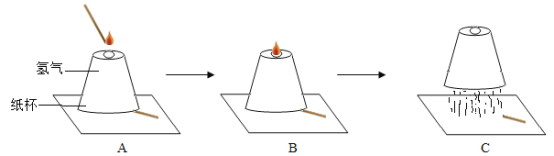
【题目】下列实验的现象或结论不正确的一组是
选项 | A | B | C | D |
实验 |
|
|
|
|
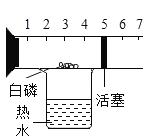
实验现象 | 打开汽水瓶盖时,汽水会自动喷出来 | 硫在空气中燃烧发出微弱的淡蓝色火 焰,硫在氧气中燃 烧发出明亮的蓝紫 色火焰 | 白磷燃烧产生大量烟,活塞先向右 再向左移动,冷却 至室温后,最终停 在刻度“4”附近 | 装铁丝的试管中有气泡产生,装铜丝 的试管中无明显现 象 |
实验结论 | 说明气体在水中的溶解度随压强的增 大而减小 | 说明氧气的浓度是影响硫燃烧剧烈程 度的因素 | 氧气约占空气体积的五分之一 | 说明铁与铜的活泼性 Fe>Cu |
A. A B. B C. C D. D