题目内容
请根据下图所示的实验过程和提供的数据(步骤②产生的气体全部逸出),回答下列问题: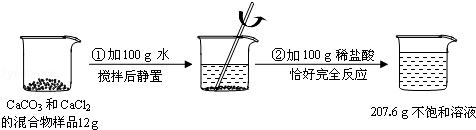
(1)原混合物样品中CaCl2的质量是多少?
(2)实验所用稀盐酸的溶质的质量分数是多少?
(1)2g (2)7.3%
答:(1)原混合物样品中CaCl2的质量为2g;(2)盐酸溶液中溶质的质量分数7.3%
解析试题分析:根据图中信息可以知道,反应前加入的物质的总质量为:12g+100g+100g=212g,而反应后剩余不饱和溶液的质量为207.6g,根据质量守恒定律可知道物质减少的质量为生成二氧化碳的质量,据此由反应的化学方程式可计算出碳酸钙的质量,进而可以求出氯化钙的质量、盐酸的质量分数。
解:(1)反应中生成CO2的质量为:12g+100g+100g﹣207.6g=4.4g
设原混合物中CaCO3的质量为x,盐酸溶液中溶质的质量为y
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73 44
x y 4.4g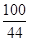 =
=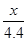
解得x=10g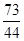 =
=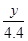
解得y=7.3g
所以原混合物样品中CaCl2的质量为:12g﹣10g=2g
(2)盐酸溶液中溶质的质量分数为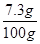 ×100%=7.3%
×100%=7.3%
答:(1)原混合物样品中CaCl2的质量为2g;(2)盐酸溶液中溶质的质量分数7.3%
考点:考查根据化学反应方程式的计算;有关溶质质量分数的简单计算

练习册系列答案
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
某化工厂生产的纯碱产品(含有少量氯化钠)的包装袋上注明:碳酸钠≥96%.
为了测定该产品中碳酸钠的质量分数是否属实,向4个分别盛有浓度相同、质量均为100g稀盐酸的烧杯中,分别放入不同质量的纯碱产品,充分反应后,称量烧杯中剩余物的质量,实验数据如下表:
| 所称量的物质 | 实验1 | 实验2 | 实验3 | 实验4 |
| 加入纯碱产品质量/g | 2.8 | 5.6 | 11.2 | 14 |
| 烧杯中剩余物质量/g | 101.7 | 103.4 | 106.8 | 109.6 |
请计算(最后结果保留一位小数):
(1)该纯碱产品中碳酸钠质量分数的标注是否真实.
(2)所用盐酸溶液中溶质的质量分数.
(3)恰好完全反应时,所得溶液中溶质的质量分数.