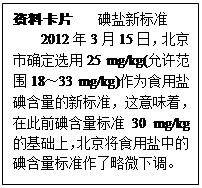题目内容
根据图示的信息计算
(1)加入的稀硫酸质量为 克.
(2)加入的稀硫酸的溶质质量分数是多少?
(1)24.5克 (2)20%
解析试题分析:(1)根据质量守恒定律结合氢氧化钾和稀硫酸的反应来求算出加入的稀硫酸的质量为:80.5g﹣56g=24.5g;
(2)设所用稀硫酸溶质的质量为x
H2SO4+2KOH═K2SO4+2H2O
98 112
x 56g×10% =
=
解得:x="4.9" g
所用稀硫酸溶质的质量分数= ×100%=20%
×100%=20%
答:所用稀硫酸溶质的质量分数为20%.
(2)根据氢氧化钾的质量结合化学方程式可以求算出稀硫酸的质量分数.
考点:根据化学反应方程式的计算;有关溶质质量分数的简单计算.

练习册系列答案
相关题目
为测定黄铜(锌铜合金)样品的组成,某同学取四个样品分别加稀硫酸做了四次实验,其实验数据记录如下表..
| 实验次数 | l | 2 | 3 | 4 |
| 取样品质量(g) | 50.0 | 50.0 | 50.0 | 50.0 |
| 取稀硫酸质量(g) | 40.0 | 80.0 | 120.0 | 160.0 |
| 产生气体质量(g) | 0.4 | 0.8 | 1.0 | 1.0 |
(1)反应的化学方程式
(2)列出计算黄铜中参加反应的金属质量(X)的比例式:
(3)参加反应的稀硫酸的溶质质量分数
(4)向第一次实验所得溶液中加入47.4g水,溶液中溶质的质量分数
(5)若工业上用125t含Cu2S 70%的辉铜矿炼制该黄铜,理论上能炼制出黄铜的质量为 。