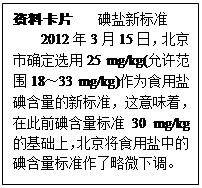题目内容
某同学对实验室中失去标签的石灰石样品进行纯度(样品中碳酸钙的质量分数)测定,取这种石灰石样品12.5g,加入94.4g一定质量分数的稀盐酸.充分反应后,共收集到4.4g二氧化碳气体(石灰石中的杂质既不溶于水,也不和稀盐酸反应).求:
(1)石灰石样品中碳酸钙的质量分数.
(2)反应后所得溶液中溶质的质量分数.
(1)80% (2)11.1%
解析试题分析:(1)设石灰石中碳酸钙的质量为x,生成的氯化钙的质量为y,则
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 111 44
x y 4.4g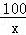 =
=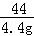 ,解得x=10g;
,解得x=10g;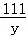 =
=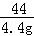 ,解得y=11.1g;
,解得y=11.1g;
该样品中碳酸钙的质量分数为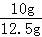 ×100%=80%;
×100%=80%;
答:石灰石样品中碳酸钙的质量分数80%;
(2)因杂质既不溶于水,也不与其他物质反应,则溶液的质量为10g+94.4g﹣4.4g=100g,溶质的质量为11.1g,
则溶质的质量分数为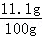 ×100%=11.1%.
×100%=11.1%.
答:反应后所得溶液中溶质的质量分数为11.1%.
考点:根据化学反应方程式的计算;有关溶质质量分数的简单计算.
点评:本题考查学生利用化学反应方程式的计算,明确二氧化碳是气体并利用质量守恒来计算二氧化碳的质量是解答的关键.

 步步高达标卷系列答案
步步高达标卷系列答案如图是某同学在厨房里看到的食用纯碱(主要成分是Na2CO3)包装袋信息,他带了一包食用纯碱到学校实验室.
(1)为测定室温下Na2CO3的溶解度,在编号为A、B、C、D的四个烧杯中各加入室温下的水100g,并分别加入取自实验室的Na2CO3固体,搅拌至充分溶解,实验数据记录如表:
| 烧杯编号 | A | B | C | D |
| 水的质量/克 | 100 | 100 | 100 | 100 |
| 加入Na2CO3的质量/克 | 30 | 35 | 40 | 50 |
| 溶液的质量/克 | 130 | 135 | 140 | 140 |
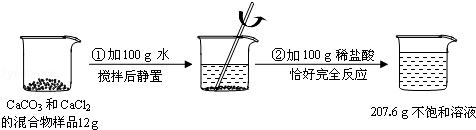
(2)为确定食用纯碱的纯度,称取自带的食用纯碱5.4g放入烧杯中,再滴加盐酸至刚好完全反应,共用去稀盐酸25g,得溶质质量为28.2g(杂质溶于水且与盐酸不反应),通过计算判断该食用纯碱中碳酸钠的质量分数是否与包装袋信息相符.(计算结果精确到0.1%)
长期使用的水壶底部都结有一层水垢,其主要成分是碳酸钙和氢氧化镁。为较准确测定水垢中氢氧化镁的含量,实验小组分别取三份同样的水垢样品各7.00g,利用如图所示装置连续进行三次实验,并将每次实验中装置B的质量变化记录于下表: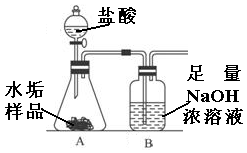
| | 第一次 | 第二次 | 第三次 | 平均值 |
| B装置增加的质量(g) | 2.17 | 2.22 | 2.21 | |
分析上面实验与数据后,回答:
⑴第一次实验测得数据较低的原因是 ;
⑵平均每份水垢样品中碳酸钙的质量为 克;
⑶水垢样品中氢氧化镁的平均质量分数为 。(计算结果精确到0.1)