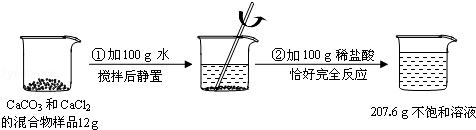
题目内容
把10g铁粉与铜粉的混合物放到盛有足量稀硫酸的烧杯中,充分反应后,烧杯中物质的总质量比反应前金属混合物与稀硫酸的总质量减少了0.1g,求混合物中铁的质量分数.
28%
解析试题分析:设参与反应的铁的质量为x,
Fe+H2SO4=FeSO4+H2↑
56 2
x 0.1g
56:2=x:0.1g
解之得:x=2.8g,
混合物中铁的质量分数为: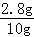 ×100%=28%.
×100%=28%.
答:混合物中铁的质量分数为28%
考点:根据化学反应方程式的计算;金属活动性顺序及其应用

练习册系列答案
相关题目
某化工厂生产的纯碱中含有少量NaCl杂质,其产品包装袋上标有:碳酸钠≥96%.为了证实该产品中碳酸钠的含量,某同学取12g该样品放入烧杯中,称得烧杯和样品总质量为132.0g再把100g稀盐酸平均分成4次加入烧杯中,每次充分反应后烧杯和剩余物总质量如下:(每次反应产生的CO2气体都全部从烧杯中逸出)
| 加入稀盐酸次数 | 1 | 2 | 3 | 4 |
| 加入稀盐酸质量/g | 25 | 25 | 25 | 25 |
| 充分反应后烧杯和剩余物总质量/g | 155.2 | 178.4 | 202.6 | 227.6 |
请你根据表中数据分析:①第1次充分反应后产生的CO2气体质量是 g
②该产品中碳酸钠的质量分数是多少?该产品是否合格?(计算后回答,计算结果精确到0.1%)