题目内容
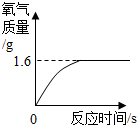
为了测定一瓶过氧化氢溶液中溶质的质量分数,某同学取该溶液50g倒入烧杯中,然后向其中加入2g二氧化锰,烧杯内混合物的质量与反应时间的变化关系如图所示。
(1)反应完全后产生氧气的质量为
(2)欲从反应后的混合物中回收二氧化锰,应进行的操作是 、干燥。
(3)计算该过氧化氢溶液中溶质的质量分数(结果保留至0.1%)。
(1)1.6
(2)过滤
(3)设溶液中H2O2的质量为x。
2H2O2MnO22H2O+O2↑
68 32
x 1.6g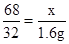
x=3.4g
该过氧化氢溶液中溶质的质量分数为: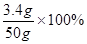 =6.8%
=6.8%
答:该过氧化氢溶液中溶质的质量分数为6.8%。
解析试题分析:(1)依据图像数据,结合根据质量守恒定律,氧气的质量为反应前物质的质量-
反应后物质的质量=502g-50.4g=1.6g;(2)二氧化锰不溶于过氧化氢和水,故分离时可采用过滤的方法;(3)用氧气的质量可求出过氧化氢的质量,再用过氧化氢的质量除以过氧化氢溶液的质量乘以100%就是过氧化氢溶液中溶质的质量分数。
考点:质量守恒定律和化学计算。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目