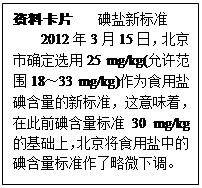题目内容
某兴趣小组的同学对食品中含有的维生素C(化学式为C6H8O6,可表示为Vc)进行探究.
(1)向含有Vc的溶液中滴加紫色石蕊,溶液变红,说明Vc具有的性质是 .
(2)食品中的Vc被氧气氧化时,其含量的变化如图所示,由此可得出的结论有 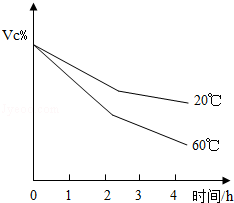
(3)小杰对某果汁饮料中Vc的含量进行测定.反应原理为C6H8O6+I2=C6H6O6+2HI,其中碘元素在反应中的 化合价变化是 .实验时取果汁饮料10mL,用煮 沸并冷却的蒸馏水稀释至50mL,向其中逐滴加入稀碘水至恰好完全反应,测得消耗碘(I2)的质量为25.4mg.则每100mL该果汁饮料中含Vc的质量是 .
(1)显酸性.
(2)温度越高,Vc被氧化的速率越快;相同温度时,放置时间越长,Vc含量越低.
(3)从0到﹣1. 176 mg.
解析试题分析:(1)向含有Vc的溶液中滴加紫色石蕊,溶液变红,说明维生素C溶液显酸性.
(2)由图中信息可知,温度越高,Vc被氧化的速率越快;相同温度时,放置时间越长,Vc含量越低.
(3)在单质碘中,碘元素的化合价是0,在碘化氢中,氢元素的化合价是+1,根据化合物中元素化合价代数和为零,可以求出碘元素的化合价是﹣1.
10mL果汁饮料消耗碘(I2)的质量为25.4mg,则100mL果汁饮料消耗碘(I2)的质量为254mg,
设每100mL该果汁饮料中含Vc的质量为X,
C6H8O6 +I2═C6H6O6 +2HI
176 254
X 254mg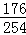 ═
═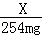
X=176mg.
考点:生命活动与六大营养素.

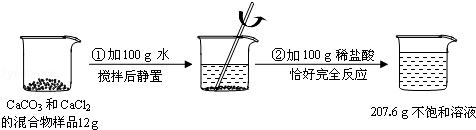
某校化学兴趣小组同学用一瓶含有少量氯化钠的硫酸钠固体样品,进行如下图所示的实验。
已知:Na2SO4 + BaCl2 = BaSO4↓ + 2NaCl
请根据以上信息,计算反应后所得溶液中溶质的质量分数。
为测定黄铜(锌铜合金)样品的组成,某同学取四个样品分别加稀硫酸做了四次实验,其实验数据记录如下表..
| 实验次数 | l | 2 | 3 | 4 |
| 取样品质量(g) | 50.0 | 50.0 | 50.0 | 50.0 |
| 取稀硫酸质量(g) | 40.0 | 80.0 | 120.0 | 160.0 |
| 产生气体质量(g) | 0.4 | 0.8 | 1.0 | 1.0 |
(1)反应的化学方程式
(2)列出计算黄铜中参加反应的金属质量(X)的比例式:
(3)参加反应的稀硫酸的溶质质量分数
(4)向第一次实验所得溶液中加入47.4g水,溶液中溶质的质量分数
(5)若工业上用125t含Cu2S 70%的辉铜矿炼制该黄铜,理论上能炼制出黄铜的质量为 。