4、硝酸的制备与性质 ★NH4+ 检验:加入NaOH加热产生的气体能使湿润的红色石蕊试纸变蓝
工业制取:(1)氨在催化剂的作用下与氧气发生反应,生成NO
4NH3 + 5O2 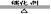 4 NO+6 H2O
4 NO+6 H2O
(2)NO与氧气反应生成NO2 2NO+O2=== 2NO2
(3)用水吸收NO2生成硝酸 3NO2 + H2O = 2HNO3+NO
性质:Cu + 4HNO3(浓)=== Cu(NO3)2+2NO2↑+2H2O 3Cu + 8HNO3(稀)==Cu(NO3)2+2NO↑+4H2O
C+ 4HNO3(浓)=== CO2↑+2NO2↑+2H2O

 常温下,浓硫酸使铁铝钝化
常温下,浓硫酸使铁铝钝化
|
|
|
|
|

|



 化学2
化学2
专题五微观结构与物质的多样性
第一单元核外电子排布
2、硫酸的性质
浓硫酸的特性⑴吸水性:浓硫酸具有吸收附着在物质表面或内部的湿存水和结晶水的性能。是液体的干燥剂。不能干燥碱性气体NH3
⑵脱水性:蔗糖的炭化 浓硫酸滴到皮肤上处理:先用抹布抹去。再用大量的水冲洗
(3)浓硫酸的强氧化性
与铜反应:2H2SO4(浓)+Cu CuSO4+SO2↑+2H2O
被还原的硫酸占反应硫酸的1/2
CuSO4+SO2↑+2H2O
被还原的硫酸占反应硫酸的1/2
与碳反应:C+2H2SO4(浓) SO2↑+ CO2↑+2H2O
SO2↑+ CO2↑+2H2O
常温下,浓硫酸使铁铝钝化


|
|
|


|
|

|
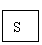
 O2
O2
H2O
NaOH
O2
O2
H2O
NaOH
O2 BaCl2
第二单元生产生活中的含氮化合物
 NH3·H2O
NH3·H2O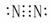
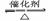 (2)SO2与氧气反应生成SO3 2SO2+O2 2SO3
(2)SO2与氧气反应生成SO3 2SO2+O2 2SO3 (2)还原性 2SO2+O2 2SO3
(2)还原性 2SO2+O2 2SO3