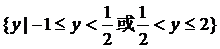以第三周期为例说明
|
原子序数 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
|||
|
元素符号 |
Na |
Mg |
Al |
Si |
P |
S |
Cl |
Ar ar |
|||
|
原子的最外电子层数 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
|||
|
原子半径 |
大 小 逐渐增大 小 逐渐增大 |
||||||||||
|
主要正价 |
+1 |
+2 |
+3 |
+4 |
+5 |
+6 |
+7 |
0 |
|||
|
主要负价 |
|
|
|
-4 |
-3 |
-2 |
-1 |
0 |
|||
|
最高价氧化物对应的水化物 |
NaOH 强碱 |
Mg(OH)2 中强碱 |
Al(OH)3 两性 |
H4SiO4 弱酸 |
H3PO4 中强酸 |
H2SO4 强酸 |
HClO4 最强酸 |
|
|||
|
金属单质与水反应的情况 |
剧烈 反应 |
缓慢 反应 |
难以 反应 |
|
|
|
|
|
|||
|
非金属单质与H2反应的条件 |
|
|
|
高温 |
较高 温度 |
需加热 |
光照或点燃 |
|
|||
|
结论 |
 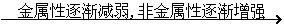 |
||||||||||
随原子序数的递增、元素原子的最外层电子排布呈周期性变化。[核外电子层数相同的原子,随原子序数的递增、最外层电子数由1递增到8]。
随原子序数的递增,元素的原子半径发生周期性的变化。[核外电子层数相同的原子,
随原子序数的递增、原子半径递减(稀有气体突增)]。
元素的化合价随着原子序数的递增而起着周期性变化。
[主要化合价:正价+1→+7;负价-4→-1,稀有气体为零价]。
元素周期律
元素的性质随着原子序数的递增而呈周期性的变化,这个规律叫做元素周期律。
说明:元素性质的周期性变化是元素原子的核外电子排布的周期性变化的必然结果。
周期性变化不是机械重复,而是在不同层次上的重复。稀有气体原子半径突然变大是同稀有气体原子半径测量方法与其它原子半径的测量方法不同。O、F没有正化合价是因为它们非金属性强。
例题 下列各组元素中,按原子半径依次增大顺序排列的是:
A、Na、 Mg、 Al B、Cl、 S、 P C、Be、N、 F D、Cl、 Br、 I
解析:Na、Mg、Al核外电子层数相同,核电荷数依次增大,原子半径依次减小,所以A错误则B正确,Be、N、F无规律比较,最外层电子数相同时随核外电子层数的增大、原子半径依次增大,所以D正确。
答案:B、D。
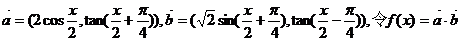 .
.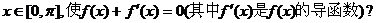 若存在,则求出x的值;若不存在,则证明之.
若存在,则求出x的值;若不存在,则证明之.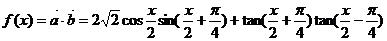
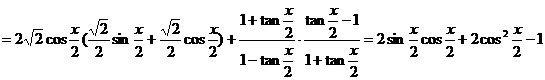
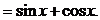
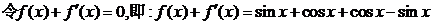

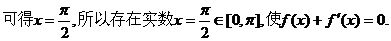
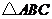 中,已知内角
中,已知内角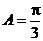 ,边
,边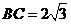 .设内角
.设内角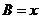 ,周长为
,周长为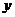 .
.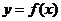 的解析式和定义域;(2)求
的解析式和定义域;(2)求 ,由
,由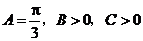 得
得 .
.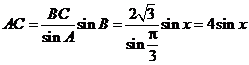 ,
,
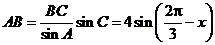 .
.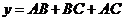 , 所以
, 所以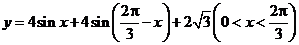 ,
,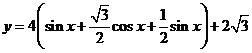
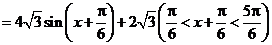 ,
, ,即
,即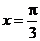 时,
时,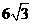 .
.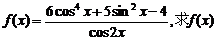 的定义域,判断它的奇偶性,并求其值域.
的定义域,判断它的奇偶性,并求其值域. 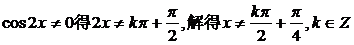 .
. 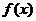 的定义域为
的定义域为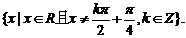

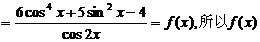 是偶函数.
是偶函数. 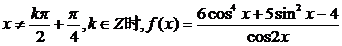
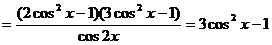 ,
,