网址:http://m.1010jiajiao.com/timu_id_3941797[举报]
元素周期表揭示了许多元素的相似性和递变规律,同一周期元素所构成的某些微粒往往具有相同的电子数,周期表中主族元素可以构成许多电子数为10或18的微粒.如下列周期表中所示的一些物质或离子.
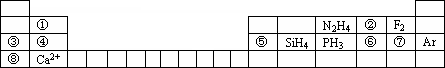
(1)写出⑥元素的离子的核外电子排布示意图________.
(2)比较③④⑤⑥⑦形成的单核离子的半径大小:________>________>________>________>________(写离子符号)
(3)①元素与⑤元素的氢氧化物有相似的性质,写出①元素的氢氧化物与足量的NaOH溶液反应的化学方程式________.
(4)分别写出含有⑥号元素的某种18电子的微粒和含有②号元素的两种10电子的离子间反应的离子方程式:________,________.
元素周期表揭示了许多元素的相似性和递变规律,同一周期元素所构成的某些微粒往往具有相同的电子数,周期表中主族元素可以构成许多电子数为10或18的微粒.如下列周期表中所示的一些物质或离子.
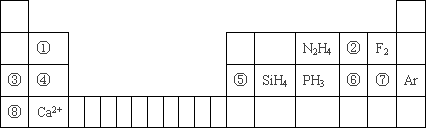
(1)写出⑥元素的离子的核外电子排布示意图________.
(2)比较③④⑤⑥⑦形成的单核离子的半径大小:________>________>________>________>________(写离子符号)
(3)①元素与⑤元素的氢氧化物有相似的性质,写出①元素的氢氧化物与足量的NaOH溶液反应的化学方程式________
(4)分别写出含有⑥号元素的某种18电子的微粒和含有②号元素的两种10电子的离子间反应的离子方程式:________,________.
(本题共10分)元素周期表揭示了许多元素的相似性和递变规律,同一周期元素所构成的某些微粒往往具有相同的电子数,周期表中主族元素可以构成许多电子数为10或18的微粒。如下列周期表中所示的一些物质或离子。
|
|
| |||||||||||||||
| ① |
|
|
|
| N2H4 | ② | F2 |
| ||||||||
③ | ④ |
| ⑤ | SiH4 | PH3 | ⑥ | ⑦ | Ar | |||||||||
⑧ | Ca2+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1)写出⑥元素的离子的核外电子排布示意图____________________。
(2)比较③④⑤⑥⑦形成的单核离子的半径大小:_____>_____>_____>_____>_____(写离子符号)
(3)①元素与⑤元素的氢氧化物有相似的性质,写出①元素的氢氧化物与足量的NaOH溶液反应的化学方程式___________________________________。
(4)分别写出含有⑥号元素的某种18电子的微粒和含有②号元素的两种10电子的离子间反应的离子方程式:________________________,_________________________。
查看习题详情和答案>>