14. (1)某同学在竖直悬挂的弹簧下加挂钩码,做实验研究弹力与弹簧伸长量的关系。下表是他的实验数据。实验时弹力始终没有超过弹性限度,弹簧很轻,自身质量可以不计。
⑴根据实验数据在给定的坐标系中做出弹力F跟弹簧伸长量x关系的图像。
⑵根据图像可知弹簧的劲度系数为 N/m(保留两位有效数字)。
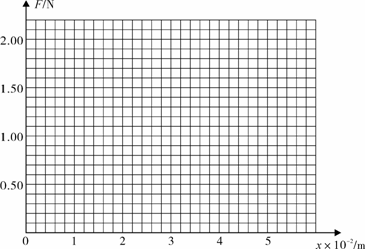
|
弹簧伸长量x/m |
弹力F/N |
|
0 |
0 |
|
0.012 |
0.30 |
|
0.023 |
0.60 |
|
0.035 |
0.90 |
|
0.046 |
1.20 |
|
0.058 |
1.50 |
 NH4++NH2-
NH4++NH2- =4.36×10-5摩/升
[Ag+]1<[Ag+]2,Cl-先沉淀。
(2) Ag2CrO4开始沉淀时[Cl-]=
=4.36×10-5摩/升
[Ag+]1<[Ag+]2,Cl-先沉淀。
(2) Ag2CrO4开始沉淀时[Cl-]=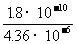 =4.13×10-6<10-5,所以能有效地分离。
=4.13×10-6<10-5,所以能有效地分离。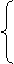
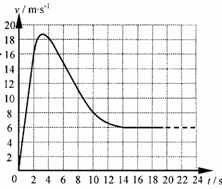 (1)t=1s时运动员的加速度和所受阻力的大小。
(1)t=1s时运动员的加速度和所受阻力的大小。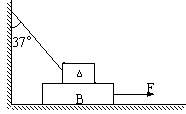 (2)此时A对B的摩擦力。
(2)此时A对B的摩擦力。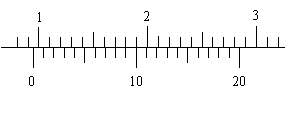 一游标卡尺的主尺最小分度为1mm,游标上有20个小等分间隔,现用此卡尺来测量一根金属圆管的外径时,卡尺上的游标位置分别如图所示,则这根圆管的外径读数是
mm。
一游标卡尺的主尺最小分度为1mm,游标上有20个小等分间隔,现用此卡尺来测量一根金属圆管的外径时,卡尺上的游标位置分别如图所示,则这根圆管的外径读数是
mm。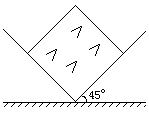 有一直角V形槽,固定放在水平面上,槽的两侧壁与水平面夹角均为45°,如图所示,有一质量为m的正方体均匀木块放在槽内,木块与槽两侧面间的动摩擦因数分别为
有一直角V形槽,固定放在水平面上,槽的两侧壁与水平面夹角均为45°,如图所示,有一质量为m的正方体均匀木块放在槽内,木块与槽两侧面间的动摩擦因数分别为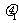 和
和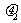 (
(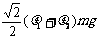 B.
B.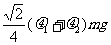
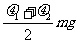 D.
D.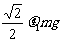
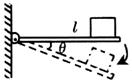
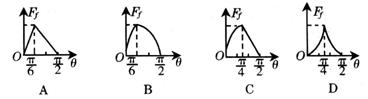
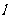 的一端固定在铰链上,木块放在木板上,开始木板处于水平位置。当木板向下转动,
的一端固定在铰链上,木块放在木板上,开始木板处于水平位置。当木板向下转动,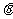 角逐渐增大的过程中,摩擦力Ff的大小随
角逐渐增大的过程中,摩擦力Ff的大小随