【题目】某实验小组探究AgNO3溶液与Na2SO3溶液的反应。
实验I | 操作 | 现象 |
| 滴加5滴0.1mol/L Na2SO3溶液,振荡 | 产生白色沉淀,测得混合溶液pH=5 |
继续滴加0.1mol/L Na2SO3溶液,振荡 | 白色沉淀增多,继续滴加,白色沉淀消失,测得混合溶液pH=9 |
资料:Ag2SO3,白色固体,难溶于水;Ag2SO4,白色固体,微溶于水;AgOH,白色固体,常温下不稳定,易分解产生棕褐色固体。
(1)测得0.1mol/L Na2SO3溶液pH=10,用离子方程式解释原因:_______。
(2)实验小组对白色沉淀的成分提出猜想:
①可能含Ag2SO3。
②可能含Ag2SO4,理由是________。
③可能含AgOH。
实验产生的白色沉淀放置一段时间后未发生明显变化,排除猜想③。
(3)检验白色沉淀的成分
(资料:Ag++2S2O32![]() Ag(S2O3)23,Ag(S2O3)23在溶液中稳定存在。)
Ag(S2O3)23,Ag(S2O3)23在溶液中稳定存在。)
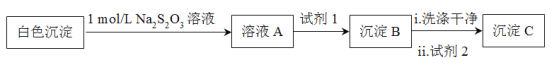
测得沉淀C质量小于沉淀B,试剂1和试剂2分别是_____、______,说明白色沉淀是Ag2SO3和Ag2SO4的混合物。
(4)探究白色沉淀消失的原因。实验小组设计对照实验:
实验II | 实验III | |
实验操作 |
|
|
现象 | 沉淀溶解 |
① 补充实验III的实验操作及现象:_______,证明SO32使白色沉淀溶解。
② 查阅资料:Ag2SO3能溶于过量Na2SO3溶液中形成Ag(SO3)23。白色沉淀中含有g2SO4,但还能全部溶解于Na2SO3溶液的原因是______。
(5)探究AgNO3溶液与Na2SO3溶液能否发生氧化还原反应。
实验IV | 操作 | 现象 |
| 步骤i:滴加一定体积0.1 mol/L Na2SO3溶液 | 产生白色沉淀 |
步骤ii:再加入NaOH溶液调pH=14,振荡 | 白色沉淀变黑,经检验为Ag |
步骤ii中Ag2SO3发生反应的离子方程式是_________。
(6)综合实验I和IV,说明AgNO3溶液与Na2SO3溶液的反应类型与_______有关。