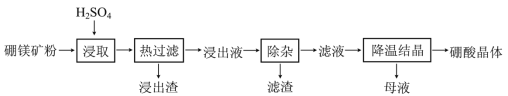
题目内容
【题目】有X、Y、Z、W、Q五种元素,它们的核电荷数依次增大,且都小于20,其中X为非金属元素。X和Q属于同一族,它们原子的最外层电子排布式为ns1;Y和W也属于同一族,它们原子的最外层的p能级电子数是s能级电子数的两倍;Z原子最外层上电子数等于W原子最外层上电子数的一半。请回答下列问题:
(1)X、Y可形成一种绿色氧化剂A,则A为__(“极性分子”或“非极性分子”);试写出Cu、稀硫酸与A反应制备CuSO4的离子方程式___。
(2)由这5种元素组成的一种化合物是__(填化学式),该物质主要用途是__,并解释其原理___。
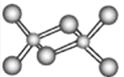
(3)在第四周期中,与Z元素原子未成对电子数相同的金属元素有___种,该元素氯化物的二聚分子结构如图所示,在此化合物中Z原子的杂化类型为___,该化合物在熔融状态下___导电(“能”或“不能”)。
(4)分子WY2、WY3的键角相比,更大的是___(填化学式),写出两种与WY3互为等电子体的微粒___。
【答案】极性分子 Cu+H2O2+2H+=Cu2++2H2O KAl(SO4)2·12H2O 净水剂 Al3++3H2OAl(OH)3(胶体)+3H+,胶体具有吸附作用 4 sp3 不能 SO3 CO32-,NO3-、BF3
【解析】
X、Y、Z、W、Q五种元素的核电荷数依次增大,且都小于20,由Y和W属于同一族,它们原子的最外层的p能级电子数是s能级电子数的两倍可知,Y为O元素、W为S元素;由X为非金属元素,X和Q属于同一族,它们原子的最外层电子排布式为ns1可知,X为H元素、Q为K元素;由Z原子最外层上电子数等于W原子最外层上电子数的一半可知,Z的最外层电子排布式为3s23p1,则Z为Al元素。
(1)由H、O可形成一种绿色氧化剂可知,A为H2O2,H2O2的结构为 ,结构不对称,属于极性分子;H2O2具有氧化性,酸性条件下,铜和双氧水发生氧化还原反应生成硫酸铜和水,反应的离子方程式为Cu+H2O2+2H+=Cu2++2H2O,故答案为:极性分子;Cu+H2O2+2H+=Cu2++2H2O;
,结构不对称,属于极性分子;H2O2具有氧化性,酸性条件下,铜和双氧水发生氧化还原反应生成硫酸铜和水,反应的离子方程式为Cu+H2O2+2H+=Cu2++2H2O,故答案为:极性分子;Cu+H2O2+2H+=Cu2++2H2O;
(2)由这5种元素组成的一种化合物是明矾,化学式为KAl(SO4)2·12H2O,明矾溶于水电离出的铝离子在溶液中水解生成氢氧化铝胶体,氢氧化铝胶体具有很大的表面积,具有很强的吸附作用,能够吸附水中悬浮的杂质,达到净水的目的,可以做净水剂,铝离子水解的离子方程式为Al3++3H2OAl(OH)3(胶体)+3H+,故答案为:净水剂;Al3++3H2OAl(OH)3(胶体)+3H+;胶体具有吸附作用;
(3)Al原子的最外层电子排布式为3s23p1,未成对电子数为1,第四周期各金属元素中,未成对电子数也为1的有K、Sc、Cu、Ga,共有4种;气态氯化铝组成为二聚体(AlCl3)2,这里Al与4个配位的Cl成键,3个为共价键,一个为配位键,则Al的杂化方式为sp3杂化;氯化铝是共价化合物,在熔融状态下不能导电,故答案为:4;sp3杂化;不能;
(4)SO2分子中S原子的价层电子对数为3,价层电子对空间构型为平面三角形,孤对电子数为1,孤对电子对对成键电子对有排斥,导致SO2分子的空间构型为V形,键角小于120 o,SO3分子中S原子的价层电子对数为3,孤对电子数为0,空间构型为平面三角形,键角为120 o,则SO3的键角大于SO2;具有相同原子个数和价电子数的微粒互为等电子体,SO3的原子个数为4,价电子数为24,则具有原子个数为4,价电子数为24的等电子体有CO32-、NO3-、BF3等,故答案为:SO3;CO32-;NO3-、BF3。

 阅读快车系列答案
阅读快车系列答案