题目内容
【题目】利用甲醇和水蒸气重整为燃料电池提供氢气。甲醇和水蒸气重整的主要反应是:反应i:CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g) △H1= +49 kJ/mol。同时,存在副反应:反应ii:CH3OH(g)
CO2(g)+3H2(g) △H1= +49 kJ/mol。同时,存在副反应:反应ii:CH3OH(g)![]() CO(g)+2H2(g) △H2= +91 kJ/mol
CO(g)+2H2(g) △H2= +91 kJ/mol
(1)反应i的平衡常数K的表达式是_______。
(2)为探究条件对反应i平衡的影响,X、 Y(Y1、Y2)可分别代表压强或温度。下图表示Y一定时,反应i中H2O(g)的平衡转化率随X的变化关系。

① X代表的物理量是_______。
② 判断Y1_______Y2(填“>”或“<”),理由是_______。
(3)CO易使反应i的催化剂中毒,研究温度和投料比对甲醇转化率及重整气中CO物质的量分数的影响,结果如图所示。

①选择250℃、水/甲醇投料比为2作为最佳条件进行反应,原因是_______。
②250℃时CO物质的量分数始终高于200℃时CO物质的量分数的原因可能是_______。
【答案】K=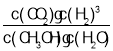 温度 > 反应i的正反应方向气体体积增大,当温度一定时,压强增大,反应向左移动,H2O(g)平衡转化率减小。 此条件下甲醇的平衡转化率最高,且CO的物质的量分数较小。 投料比一定,温度升高,反应ii向右移动,反应i也向右移动使c(CH3OH)减少而使反应ii左移,温度对反应ii的影响较后者大,所以整体表现为250℃时CO含量较高。
温度 > 反应i的正反应方向气体体积增大,当温度一定时,压强增大,反应向左移动,H2O(g)平衡转化率减小。 此条件下甲醇的平衡转化率最高,且CO的物质的量分数较小。 投料比一定,温度升高,反应ii向右移动,反应i也向右移动使c(CH3OH)减少而使反应ii左移,温度对反应ii的影响较后者大,所以整体表现为250℃时CO含量较高。
【解析】
(1)直接根据平衡常数的定义即可表示出平衡常数的表达式。
(2)反应i的特点是:气体分子数增多,水的平衡转化率随压强的增大而减小;反应吸热,水的平衡转化率随温度的升高而增大。依此可判断图中X、Y分别代表的物理量以及Y1、Y2的关系。
(3)从图中可知:随着水/甲醇投料比增大,甲醇转化率增大;CO的物质的量分数在200℃时减小不明显,在250℃时,随着水/甲醇投料比的增大而明显减小。根据这些特点及反应本身的特点,运用勒夏特列原理,可以对①、②小题进行解答。
(1)根据平衡常数的定义,反应i:CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g) 的平衡常数K表达式是:K=
CO2(g)+3H2(g) 的平衡常数K表达式是:K=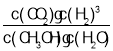 ,故答案为: K=
,故答案为: K=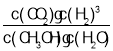
(2)①.根据分析可知:反应i中,水的平衡转化率随温度的升高而增大,随压强的增大而减小,故X为温度符合题意,X为压强不符合题意,故X表示温度;②.温度相同时,增大压强平衡逆向移动,水的平衡转化率下降,故Y2压强大于Y1的,故答案为:温度;>;反应i的正反应方向气体体积增大,当温度一定时,压强增大,反应向左移动,H2O(g)平衡转化率减小
(3)①.一氧化碳能使催化剂中毒,所以在选择条件时,应在照顾甲醇转化率的同时,尽量减少一氧化碳的物质的量分数。相同投料比时,250℃比200℃甲醇转化率高,且在水/甲醇投料比为2时,一氧化碳物质的量分数降低明显。所以反应选择250℃和水/甲醇投料比为2条件最佳,故答案为:此条件下甲醇的平衡转化率最高,且CO的物质的量分数较小
②.反应i、ii均为吸热反应,所以温度高,均有利于向正向移动。i的正向移动使甲醇浓度降低,氢气浓度升高从而使抑制了反应ii的正向移动,使一氧化碳浓度下降;而ii的正向移动使CO含量升高,两个相反的影响总的结果根据图示可知:升高温度对反应ii的影响大于对反应i的影响,即温度在250℃时比200℃时CO物质的量分数高,故答案为:投料比一定,温度升高,反应ii向右移动,反应i也向右移动使c(CH3OH)减少而使反应ii左移,温度对反应ii的影响较后者大,所以整体表现为250℃时CO含量较高

【题目】在密闭容器中发生下列反应:I2(g)+H2(g)![]() 2HI(g)(正反应为放热反应)。起始时,n(H2)=a mol,n(I2)=b mol。只改变表中列出的条件,其他条件不变,试将化学反应速率的改变填入相关的表格中(填“增大”“减小”或“不变”)。
2HI(g)(正反应为放热反应)。起始时,n(H2)=a mol,n(I2)=b mol。只改变表中列出的条件,其他条件不变,试将化学反应速率的改变填入相关的表格中(填“增大”“减小”或“不变”)。
编号 | 改变的条件 | 反应速率 |
(1) | 升高温度 | ______ |
(2) | 加入正催化剂 | ______ |
(3) | 再充入a mol H2 | ______ |
(4) | 将容器的容积扩大到原来的2倍 | ______ |
(5) | 保持容积不变,通入b mol Ne | ______ |
【题目】某学生为了探究锌与盐酸反应过程中的速率变化,他在100 mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气(标准状况),实验记录如下(累计值):
时间/min | 1 | 2 | 3 | 4 | 5 |
氢气体积/mL | 50 | 120 | 232 | 290 | 310 |
(1)在0~1 min、1~2 min、2~3 min、3~4 min、4~5 min时间段中,反应速率最大的时间段是________,原因为______________________;反应速率最小的时间段是________,原因为__________________________。
(2)在2~3 min内,用盐酸的浓度变化表示的反应速率为________。
(3)为了减缓反应速率但不减少产生氢气的量,在盐酸中分别加入等体积的下列溶液,其中可行的是________。
A.蒸馏水 B.Na2SO4溶液
C.NaNO3溶液 D.Na2CO3溶液