【题目】某些氮的化合物是引起大气污染、水体污染和土壤污染原因之一。
I.汽车和工业废气中的氮氧化物是城市空气污染的主要来源。氮氧化物处理通常有下列途径:
(1)在汽车排气管内安装催化转化器,其反应为2NO(g) +2CO(g)= 2CO2(g) +N2(g)。
①该反应能够正向自发进行,则正反应的ΔH_________0(填“>”或“<”)。
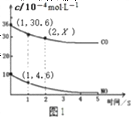
②根据传感器记录某温度下,NO、CO的反应进程,测量所得数据绘制出图1。前1s内平均反应速率v(N2)=__________mol/(L·s);第2s时的X值范围_________________________。
(2)烟气中的氮氧化物(NOx)可与甲烷在一定条件下反应转化为无害成分,从而消除污染。已知
反应 | 反应热(△H/kJ·mol-1) | 平衡常数(K) |
CH4(g)+2O2(g)═CO2(g)+2H2O(l) | a | K1 |
N2(g)+O2(g)═2NO(g) | b | K2 |
则CH4脱硝的热化学方程式为CH4(g) + 4NO (g)![]() CO2(g) + 2N2(g) + 2H2O (l)ΔH=_________kJ/mol(用a、b表示);平衡常数K3=_________(用K1、K2表示)。
CO2(g) + 2N2(g) + 2H2O (l)ΔH=_________kJ/mol(用a、b表示);平衡常数K3=_________(用K1、K2表示)。
II.氰化钠是一种重要的基本化工原料。“天津港”爆炸中,氰化钠产生泄漏,为了避免给土壤和水体带来污染,消防员通过喷洒双氧水来处理泄漏的氰化钠。
(3)已知:NaCN + H2O2+ H2O=NaHCO3+ NH3↑,用H2O2处理1mol NaCN时,反应中转移电子的物质的量为_________mol(NaCN中C为+2价)。
(4)某兴趣小组检测处理后的氰化钠废水是否达标。
已知:①废水中氰化钠的最高排放标准为0.50 mg/L。
②Ag++2CN-= [Ag(CN)2]-,Ag++I-= AgI↓,AgI呈黄色,且CN-优先与Ag+反应。
③实验如下:取30.00mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂,用1.000×10-4mol/L的AgNO3标准溶液滴定,消耗AgNO3溶液的体积为1.50 mL。
④滴定终点的判断方法是_________。
⑤经计算处理后的废水中NaCN的浓度为_________mg/L(保留两位小数),处理后的废水是否达到排放标准:________(填“是”或“否”)
III.工业废水中,含有NaNO2。NaNO2固体外观酷似食盐,误食会中毒。可用电解法将废水中少量的![]() 转化为N2以降低其危害。写出
转化为N2以降低其危害。写出![]() 在酸性条件下转化为氮气的电极反应式为_____________。
在酸性条件下转化为氮气的电极反应式为_____________。