题目内容
【题目】现有下列物质
①NaCO310H2O 晶体 ②铜 ③浓硫酸 ④CO2 ⑤NaHSO4 固体 ⑥Ba(OH)2 固体 ⑦红褐色的 氢氧化铁胶体 ⑧氨水 ⑨稀硝酸 ⑩Al2(SO4)3
(1)上述物质属于强电解质的有___________________(填编号)。
(2)上述物质中有两种在水溶液中可发生离子反应:H+ +OH﹣=H2O,写出对应的化学方程式___________________________________。
(3)⑩可以作净水剂,请用离子方程式解释其原因_____________。17.1g的⑩溶于水配成 250mL 溶液,![]() 的物质的量浓度为______________。
的物质的量浓度为______________。
(4)将⑥的溶液滴加到⑤的溶液中至恰好沉淀,发生反应的离子方程式_____________________。
(5)②与⑨发生反应的化学方程式为 ![]() 。当有0.6mol电子转移时,生成的气体标准状况下的体积为________L。
。当有0.6mol电子转移时,生成的气体标准状况下的体积为________L。
【答案】①⑤⑥⑩ 2HNO3 + Ba(OH)2= Ba(NO3)2 + 2H2O ![]() 0.6 mol/L H++ SO42-+ Ba2++ OH-=BaSO4↓+ H2O 4.48
0.6 mol/L H++ SO42-+ Ba2++ OH-=BaSO4↓+ H2O 4.48
【解析】
(1)①⑤⑥⑩溶于水的部分或者熔融状态时,可以完全变成阴、阳离子,属于强电解质,故答案为:①⑤⑥⑩;
(2)强酸与强碱反应生成可溶性盐和水的离子反应为H++OH-=H2O,如2HNO3+Ba(OH)2═Ba(NO3)2+2H2O,故答案为:2HNO3+Ba(OH)2═Ba(NO3)2+2H2O;
(3)Al2(SO4)3中的铝离子水解得到的氢氧化铝具有净水作用,即Al3++3H2OAl(OH)3(胶体)+3H+;17.1g的⑩Al2(SO4)3溶于水配成250mL溶液,SO4的物质的量浓度为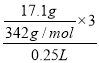 =0.6mol/L;故答案为:Al3++3H2OAl(OH)3(胶体)+3H+;0.6mol/L;
=0.6mol/L;故答案为:Al3++3H2OAl(OH)3(胶体)+3H+;0.6mol/L;
(4)将⑥Ba(OH)2的溶液滴加到⑤NaHSO4的溶液中,则硫酸根和氢离子之间按照1:1进行反应至恰好沉淀,发生的反应为:H++SO42-+Ba2++OH-═BaSO4↓+H2O;故答案为:H++SO42-+Ba2++OH-═BaSO4↓+H2O;
(5)反应3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O,产生2molNO同时会伴随6mol电子转移,当有0.6mol电子转移时,生成的气体为0.2mol,即标准状况下的体积为4.48L.故答案为:4.48。

 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案