题目内容
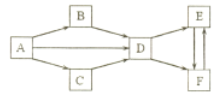
【题目】A-F 为中学化学常见物质,它们的焰色试验均为黄色。其中 A 为单质, B 与 C的组成元素相同,且 B 为淡黄色固体; D、 E、 F 的溶液均显碱性,其中 E 和 F 属于盐且相同物质的量浓度的溶液, E溶液的碱性更强。它们之间的相互转化关系如下图。(“![]() ”表示进一步反应即可转化,部分反应物、生成物和反应条件已略去)
”表示进一步反应即可转化,部分反应物、生成物和反应条件已略去)
请回答下列问题:
(1)写出下列物质的化学式: B___, C___, E___。
(2)A![]() D 的化学方程式是_______________________。
D 的化学方程式是_______________________。
(3)B![]() D 的化学方程式是_______________________。
D 的化学方程式是_______________________。
(4)区分 E 和 F 两种固体的方法是:分别取等量的 E 和 F 两种固体少许于试管中,具体的操作现象和结论是_________________________。
【答案】Na2O2 Na2O Na2CO3 2Na + 2H2O = 2NaOH + H2↑ 2Na2O2 + 2H2O = 4NaOH + O2↑ 加热试管,将导气管插入澄清石灰水中E试管的澄清石灰水没有明显变化,F试管的澄清石灰水变浑浊,说明F是 NaHCO3,E 是 Na2CO3(或向两试管中分别加入等量的CaCl2溶液E试管中产生白色沉淀,F试管中无明显现象)
【解析】
A-F 为中学化学常见物质,它们的焰色试验均为黄色。其中 A 为单质,则A为Na; B 与 C的组成元素相同,且 B 为淡黄色固体,则B为Na2O2,C为Na2O; D、 E、 F 的溶液均显碱性,其中 E 和 F 属于盐且相同物质的量浓度的溶液, E溶液的碱性更强,D为NaOH,E为Na2CO3,F为NaHCO3,据此分析问题。
(1)根据上面分析可知:B为Na2O2, C为Na2O, E为Na2CO3。
答案:Na2O2;Na2O;Na2CO3;
(2)根据上面分析可知A为Na,D为NaOH,A![]() D 的化学方程式是2Na + 2H2O = 2NaOH + H2↑;
D 的化学方程式是2Na + 2H2O = 2NaOH + H2↑;
答案:2Na + 2H2O = 2NaOH + H2↑;
(3)根据上面分析可知B为Na2O2,D为NaOH ,B![]() D 的化学方程式是2Na2O2 + 2H2O = 4NaOH + O2↑;
D 的化学方程式是2Na2O2 + 2H2O = 4NaOH + O2↑;
答案:2Na2O2 + 2H2O = 4NaOH + O2↑;
(4)根据上面分析可知E为Na2CO3,F为NaHCO3,利用 2NaHCO3![]() Na2CO3+H2O+CO2而碳酸钠受热不分解或者利用Na2CO3+CaCl2=2NaCl+CaCO3↓而碳酸氢钠不与氯化钙反应进行区分;
Na2CO3+H2O+CO2而碳酸钠受热不分解或者利用Na2CO3+CaCl2=2NaCl+CaCO3↓而碳酸氢钠不与氯化钙反应进行区分;
答案:加热试管,将导气管插入澄清石灰水中E试管的澄清石灰水没有明显变化,F试管的澄清石灰水变浑浊,说明F是 NaHCO3,E 是 Na2CO3(或向两试管中分别加入等量的CaCl2溶液E试管中产生白色沉淀,F试管中无明显现象)。